Antimonio, Sb, número atómico 51
Precio del antimonio, historia, ocurrencia, extracción y uso
antimonio
El antimonio (del latín Antimonium, probablemente del árabe "al-ithmîd (un)" es un elemento químico con el símbolo del elemento Sb (del latín Stibium, brillo de lucio (gris)) y el número atómico 51 En la tabla periódica está en el 5. Periodo y el grupo principal 5, o 15, grupo IUPAC o grupo nitrógeno. En la modificación estable, es un semi-metal quebradizo y brillante de plata.
Nombre, historia
También se cree que el nombre se remonta al último himno griego (floración alemana). El objetivo era describir los cristales en forma de tallo del sulfuro de antimonio, que aparecían como mechones de flores y parecían una flor. En el 11. Century se encuentra el término latino para el medicamento antimonio de la medicina mineral para la terapia interna de enfermedades que entonces se usa con Constantinus Africanus.
En el 17. En el siglo XIX, el nombre antimonio se usaba para referirse al metal. El término copto para el maquillaje en polvo de sulfuro de antimonio fue sobre el griego en el estibio latino. La abreviatura Sb utilizada por el médico y químico sueco Jöns Jakob Berzelius ("padre de la química moderna") todavía se usa hoy como símbolo de un elemento.
Una etimología popular legendaria tardía inmortalizada por Samuel Johnson en su diccionario dice que el monje alemán Basilius Valentinus observó que los cerdos engordaban rápidamente al absorber el antimonio. También intentó esto en sus frailes, con lo cual murieron, sin embargo, de modo que se acuñó el término "antimoine" (antimonio), del cual se creó más tarde "antimonio".
Una localidad típica de antimonio sólido es la mina de plata en el municipio sueco de Sala en Västmanland. Sin embargo, el antimonio metálico ya era conocido por los chinos y los babilonios. Algunos de sus compuestos ya se usaron en la Edad del Bronce como un suplemento del cobre para producir bronce (hallazgos de Velem St. Vid en Hungría).
Ocurrencia
El antimonio es un elemento raro. Dado que también se puede encontrar en la naturaleza (es decir, en forma elemental), está certificado por la Asociación Internacional de Mineralogía (IMA) bajo el sistema no. 1.CA.05 reconocido como mineral.
El antimonio sólido (2011) se ha detectado en todo el mundo en los sitios 300. Entonces, entre otras cosas, en varias regiones de Australia; en los departamentos bolivianos de La Paz y Potosí; Minas Gerais en Brasil; Selva Negra, Fichtelgebirge, Bosque del Alto Palatinado, Odenwald y Harz en Alemania; Seinäjoki en Finlandia; varias regiones de Francia; Lombardía, Piamonte, Cerdeña y Trentino Alto Adige en Italia; algunas regiones de Canadá; algunas regiones de Austria; Siberia oriental y occidental y los Urales en Rusia; además de Västmanland, Dalarna, Gästrikland, Närke, Södermanland, Värmland y Västerbotten en Suecia; en algunas regiones de Eslovaquia; Bohemia y Moravia en la República Checa, así como en muchas regiones de los Estados Unidos. Uno de los depósitos más importantes del mundo de antimonio sólido y minerales de antimonio es el cinturón de piedra verde de Murchison en la Cordillera de Murchison de Sudáfrica.
Hasta ahora, se conocen los minerales de antimonio 264 (a partir de: 2010). Se utiliza principalmente el mineral de sulfuro Stibnit Sb2S3 (Grauspießglanz) con un contenido máximo de 71,7% Sb. El mineral con el mayor contenido de Sb en un compuesto químico es la Paradocrasit de aleación de arsénico antimonio natural (max 92%). Sin embargo, viene con solo tres localidades, en contraste con Stibnit (alrededor de los sitios 2500), mucho menos común. Otras fuentes de antimonio son los minerales Valentinit Sb2O3 (Weißspießglanz), Breithauptit NiSb (antimonio níquel, antimonuro de níquel), Kermesit Sb2S2O (brillo de saliva roja) y Sb2S5 (azufre de oro).
Extracción y presentación.
Técnicamente, el antimonio se extrae del brillo de antimonio. Un método se basa en el tostado y la reducción con carbono (método de reducción reductora):
Otra posibilidad es realizar la reducción con hierro (método de precipitación):
Todo el mundo estaba al comienzo de 21. Siglo entre 110.000 y 160.000 toneladas de antimonio promovidas por año. Desde 1900, la producción ha aumentado más de diez veces.
El 87% de la producción de antimonio tiene lugar en China (a partir de: 2015).
Propiedades
El antimonio puede ocurrir en tres modificaciones diferentes, siendo el antimonio metálico o gris la modificación más consistente.
En condiciones normales, el antimonio cristaliza trigonal en configuración romboédrica en el grupo espacial R3m (no. 166) descrito de acuerdo con el simbolismo de Hermann Mauguin con los parámetros de la red a = 431 pm yc = 1127 pm, así como seis unidades de fórmula por unidad de celda.
Al enfriar el vapor de antimonio en superficies frías, se forma antimonio amorfo, negro y altamente reactivo, que se convierte de nuevo en antimonio metálico mediante calentamiento. La producción electrolítica produce antimonio explosivo que, cuando se agrieta, se vuelve explosivamente brillante y chispea en antimonio metálico. Sin embargo, este formulario siempre contiene algo de cloro y no puede considerarse una modificación. El antimonio amarillo tampoco es una modificación independiente, sino un compuesto químico altamente polimérico con hidrógeno.
Propiedades fisicas
El antimonio metálico es blanco plateado, muy brillante, escamoso y cristalino. Es fácil de aplastar debido a su fragilidad. La conductividad eléctrica y térmica es baja.
Propiedades quimicas
Con hidrógeno naciente, el antimonio reacciona con el hidruro de antimonio inestable SbH3. El aire y el agua no atacan el antimonio a temperatura ambiente. Por encima del punto de fusión, arde en el aire con una llama blanca azulada al óxido de antimonio (III). Se disuelve en ácidos minerales concentrados calientes. Con los halógenos, reacciona vigorosamente a temperatura ambiente a los haluros correspondientes.
En los compuestos, el antimonio está presente principalmente en los estados de oxidación + 3 y + 5. En los antimonuros metálicos como el antimonuro de potasio K3Sb forma iones Sb3.
isótopo
Hay dos isótopos de antimonio estables: 121Sb y 123Sb.
Uso y aleaciones
La mayoría del antimonio producido se procesa en aleaciones y muestra las siguientes propiedades:
Sirve para endurecer aleaciones de plomo y estaño. A diferencia de la mayoría de los otros metales, se expande al enfriar la masa fundida (debido a la conversión a otra modificación): el contenido de antimonio se puede ajustar para que tales aleaciones no se contraigan o incluso se expandan un poco; Cuando las piezas se producen en moldes de fundición, el metal presiona durante la solidificación en todas las esquinas y ángulos, de modo que incluso las formas complicadas y las superficies muy estampadas pueden quedar libres de huecos.
Aleaciones importantes:
- Aleaciones de plomo-antimonio: plomo duro, metal de carta, metal de cojinete, plomo de acumulador, cubierta de plomo para cables subterráneos
- Aleaciones de estaño y antimonio: Britannia metal, teniendo metal
- Producción de semiconductores, p. Ej. B. por dopaje de silicio, para la producción de semiconductores compuestos III V
- Aleaciones de estaño, antimonio y cobre (metal de conejo) para metales portantes
- Aleaciones de estaño, antimonio, cobre y plomo para peltre y otros artículos de estaño
la llamada soldadura o soldadura blanda - Antimonio de aluminio, antimonio de galio, antimonio de indio para dispositivos infrarrojos y de efecto Hall
- Aleaciones de antimonio sin contracción para fundición de precisión
Medicina
El antimonio (o una preparación derivada del mineral de antimonio) estaba en el 16. y 17. Se convirtió en una "medicina de plomo" (iatroquímica), pero fue, como otras drogas paracelsianas, controvertida y también prohibida en Francia entre 1615 y 1688.
El tártaro se ha utilizado durante mucho tiempo como agente refractivo (píldora de antimonio), hoy en día todavía se usa a veces para estudiar el contenido del estómago de las aves.
Tanto la esquistosomiasis como los tripanosomas comenzaron al comienzo de 19. Siglo con Brechweinstein (Kaliumantimonyltartrat) luchó. La piedra tártaro se hizo almacenando vino en una copa de antimonio durante un día y luego bebiéndolo. Mientras tanto, se usan medicamentos más efectivos y más compatibles.
Los suplementos de antimonio se usan comúnmente como formas pentavalentes menos tóxicas para el tratamiento farmacológico de la leishmaniasis y la esquistosomiasis, pero ya no son el fármaco de primera elección en los países desarrollados. El antimonio inhibe la enzima fosfofructoquinasa, que es el paso limitante en la glucólisis.
más
- Partido de Kindling
- Parte de los detonadores de explosivos y municiones con plomo.
- Trisulfuro de antimonio en las pastillas de freno de los vehículos.
Antimonio (V) sulfuro de: - para la producción (vulcanización) de caucho rojo (ejemplo: mangueras de caucho de laboratorio)
- como un componente rojo de la cabeza de disparo en partidos
- antes del maquillaje de ojos y en oftalmología ("Augenerweiterer")
- Cromato de antimonio como pigmento de color amarillo.
óxidos de antimonio - Catalizador para la producción de poliéster y PET (óxido de antimonio (III))
- como pigmento blanco para colorear poliestireno, polietileno y polipropileno
- Producción de esmaltes blancos y fritas (porcelana)
- Purificación de vidrio con plomo
- dopado con estaño como un revestimiento transparente conductor (óxidos de antimonio-estaño "ATO"), por ejemplo en vidrios, para la producción de pantallas o en pigmentos conductores de electricidad ("Minatec"), para revestimientos de piso para disipar cargas electrostáticas.
- en pigmentos ("Lazerflair") para el marcado con láser de piezas de plástico, debido a la fuerte absorción de la radiación infrarroja láser de marcado habitual (Nd: YAG).
- en camuflaje debido a la fuerte absorción infrarroja.
- como retardante de llama y como componente de pinturas ignífugas y resistentes al fuego,
- Plásticos y textiles para revestimiento de cables, fundas para asientos de automóviles, telas para cortinas, ropa para niños y más. Ä.
- Sales de antimonio como componente de pesticidas, manchas y fuegos artificiales.
- Divisor para oro: para la precipitación de plata del oro fundido
toxicidad
El antimonio puede ser fatal en la ingestión de 200 a 1200 mg. En toxicología, se conocen tres formas de antimonio, de las cuales el hidruro de antimonio gaseoso (Stiban, SbH3) es la forma más peligrosa que induce la hemólisis masiva. Después de la toxicidad, el tártaro emético sigue con antimonio trivalente ("trivalente"), mientras que el antimonio pentavalente es el menos tóxico.
El antimonio trivalente se absorbe en los glóbulos rojos dentro de las primeras dos horas después de la ingestión hasta 95% y, por lo tanto, se enriquece principalmente en órganos fuertemente perfundidos. La excreción se debe principalmente a la unión al glutatión a través de la bilis con una circulación enterohepática correspondientemente alta, y solo una pequeña parte se elimina a través de los riñones. El tartrato de antimonil potasio se excreta a 90% dentro del primer día después de la ingestión, el resto es 10% debido a una cinética de eliminación más lenta durante los días 16.
Se cree que el antimonio como el arsénico inhibe similar a la función del complejo piruvato deshidrogenasa y por lo tanto un defecto en el trifosfato de adenosina fuente de energía intracelular (ATP) conduce. Esto conduce a la formación de complejos de quelato de entre los grupos de antimonio y tiol de las enzimas respectivas. En el cuerpo es tóxico en numerosos órganos, como en el tracto digestivo, el hígado, los riñones, el corazón y el sistema nervioso central. La concentración más alta alcanzó antimonio en el hígado, donde puede haber una hepatitis hasta la insuficiencia hepática. En el fondo se trata de cambios en el ECG con inversión y la reducción de la onda T y prolongación del intervalo QT. La insuficiencia renal aguda puede conducir a la hemodiálisis temporal o permanente.
Además de las medidas de apoyo, como la terapia de infusión (tanto para compensar la pérdida de líquido a través del vómito como para proteger los riñones) y la estrecha monitorización de los signos vitales y el ECG, el carbón activado, N-acetilcisteína como precursor del glutatión, se usa para el envenenamiento antimicrobiano. secreción aumentada y un agente quelante, por ejemplo. B. Dimercaprol.
Los resultados de la investigación indican que los compuestos de antimonio irritan la piel y las membranas mucosas. Estos compuestos probablemente se disuelven del plástico y los textiles.
Instrucciones de seguridad y valores límite.
De los compuestos de antimonio son fluoruro de antimonio por la UE como tóxico (T) y también clasificada como cloruros corrosivos (C), como peligrosos para el medio ambiente (N); todos los demás compuestos de antimonio como nocivo (Xn) y peligroso para el medio ambiente (N). sí antimonio no está en la lista, de acuerdo con la hoja de datos de seguridad se designa como un irritante.
La Agencia Internacional para la Investigación del Cáncer (IARC) clasifica el óxido de antimonio (III) como una posible sustancia cancerígena.
En la UE, el agua potable tiene un límite de 5 μg / l. Los exámenes de jugo de fruta embotellado en botellas de PET (para las cuales no hay pautas) revelaron concentraciones de antimonio de hasta 44,7 μg / L en concentrados de jugo sin diluir.
La UE añadió antimonio a 2016 en virtud del Reglamento (CE) nº 1907 / 2006 (REACH) en el contexto de la evaluación de sustancias en el plan de acción comunitario (CoRAP). Reevaluará el impacto de la sustancia en la salud humana o el medio ambiente y, cuando corresponda, iniciará el seguimiento. Las principales razones para la absorción de antimonio fueron las preocupaciones sobre la exposición de los trabajadores, el alto tonelaje (agregado), la relación de alto riesgo (RCR) y el uso generalizado, así como el riesgo potencial de propiedades cancerígenas. La revaluación se ejecuta desde 2018 y la lleva a cabo Alemania.
prueba
pruebas preliminares:
Coloración de la llama: Llama azul pálido, poco característico Fosforalzperla: Incoloro (perturbado por todos los elementos que producen una perla de color)
reacción de detección:
Reducción por metales básicos, por ejemplo hierro, zinc o estaño.
En soluciones no ácidas, los metales básicos reducen los cationes de antimonio Sb (III), Sb (V) y Sb (III) / (V) a antimonio metálico:
2 Sb3 + + 3 Fe → 2 Sb + 3 Fe2 +
La sustancia a analizar para detectar antimonio se coloca en solución de ácido clorhídrico y se mezcla con polvo de hierro. El resultado es un precipitado negro y escamoso de antimonio metálico en la solución o directamente sobre el hierro. La prueba de un clavo de hierro también es posible. Aquí, un depósito negro en la uña es una prueba de antimonio, que se ha depositado aquí en la primaria.
La muestra Marsh permite una detección clara de antimonio. Cuando la sustancia depositada pirolíticamente (espejo oscuro brillante) no se disuelve en peróxido de hidrógeno amoniacal, se excluyen el arsénico y el germanio como posibles alternativas.
La determinación altamente sensible de pequeñas trazas de antimonio se produce a través de la técnica de hidruro de espectrometría atómica. En principio, la muestra de Marsh se combina con la espectrometría de absorción atómica. Los efectos matriciales de la solución de muestra se pueden suprimir de manera muy efectiva.
Otro método es tratar una solución acuosa que contiene iones de antimonio con solución de rodamina B. Forma un complejo coloreado que se puede extraer con éter isopropílico. Sin embargo, esta evidencia es bastante inespecífica, ya que los iones de oro, cadmio, galio, talio, uranio y tungsteno forman complejos coloreados.
Conexiones
- Hidrógeno de antimonio, también llamado monostiban SbH3.
- Gas tóxico que se forma a partir de antimonio y ácidos.
- Distiban (Sb2H4)
compuestos halogenados
- El fluoruro de antimonio (V) (SbF5) forma (según VSEPR) una pirámide cuadrada y se hibrida con sp3d
- Cloruro de antimonio (V) (SbCl5)
- Fluoruro de antimonio (III) (SbF3)
- Cloruro de antimonio (III) (SbCl3)
- Antimonio (III) de bromuro de (SbBr3)
- Yoduro de antimonio (III) (SbI3)
compuestos oxigenados
- Óxido de antimonio (III) (trióxido de antimonio, Sb2O3)
- Óxido de antimonio (III, V) (tetróxido de antimonio, Sb2O4)
- Óxido de antimonio (V) (pentaóxido de antimonio, Sb2O5)
- Ácido de antimonio / trihidróxido de antimonio (H3SbO3 / Sb (OH) 3)
- Ácido de antimonio / ácido de antimonio (III), SbOOH o HSbO2
- Ácido antimónico (HSb (OH) 6)
compuestos de azufre
- Trisulfuro de antimonio, también llamado brillo de antimonio (Sb2S3)
Tallos metálicos gris-negro brillante. Material de partida para la producción de antimonio metálico. Soluble en ácidos fuertes. Úselo para fósforos, gafas de frotar y pinturas de camuflaje (reflejo de la luz IR). - Pentasulfuro de antimonio, anteriormente conocido como azufre de oro (Sb2S5)
Otros compuestos
- Fluoruro de cloruro de antimonio (V) (SbCl4F) (catalizador para la producción de politetrafluoroetileno ("Teflón"))
- Antimoniuro de aluminio (AlSb)
- Antimonuro de galio (GaSb)
- Antimonuro de indio (InSb)
Gráfico de antimonio 2005-2020
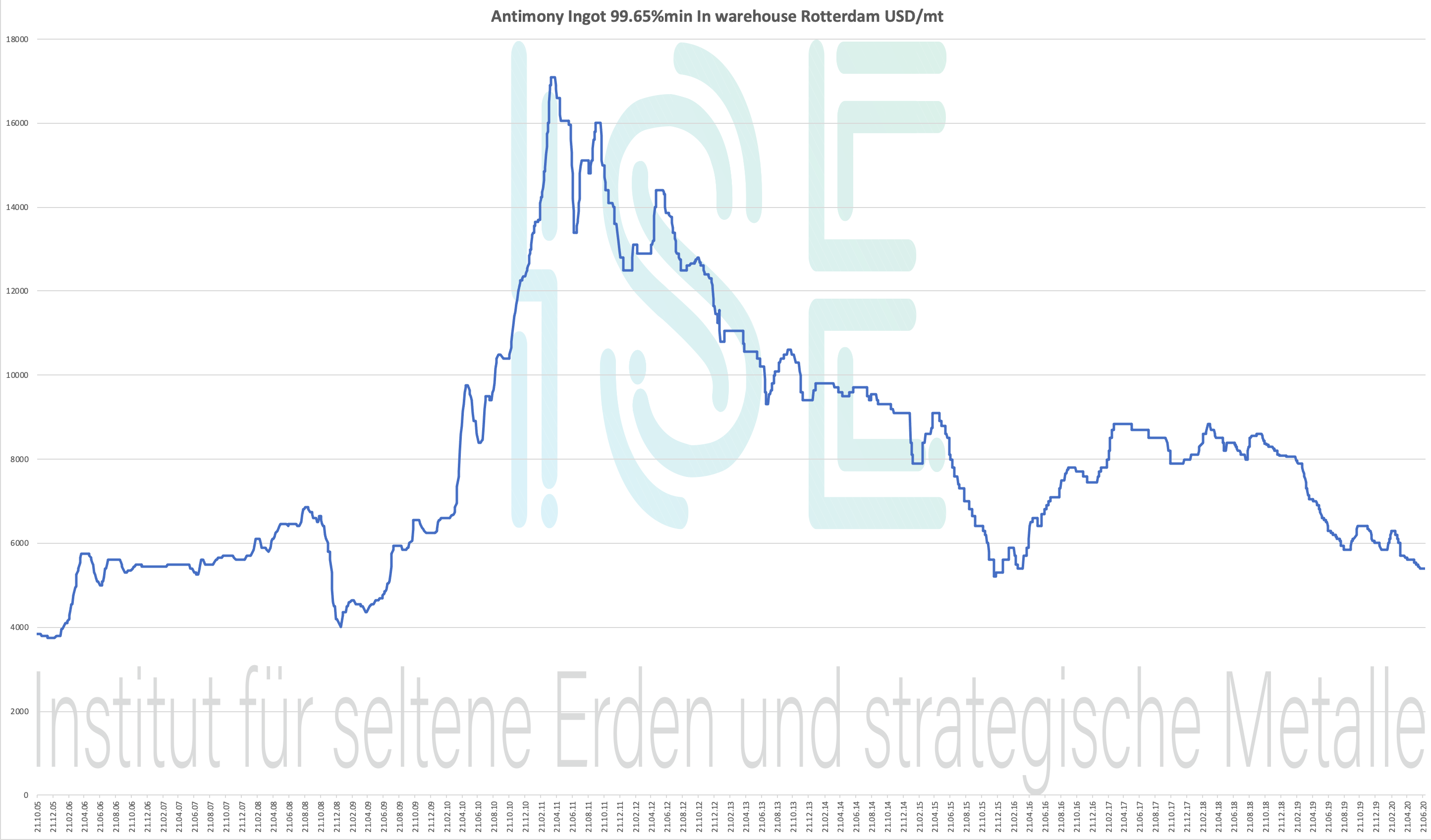
Lingote de antimonio 99.65% min En almacén Rotterdam USD / tm
Tabla de precios 2004-2020 - haga clic para ampliar
Precio del antimonio: por debajo del precio estratégico de los metales
Datos históricos de precios del lingote de antimonio 99,65% almacén Rotterdam USD / tm



