Cromo, Cr, número atómico 24
Cromo - Extracción de cromo, uso, precios
General
El cromo (alt. Χρῶμα chrṓma, color ') es un elemento químico con el símbolo del elemento Cr y el número atómico 24. Pertenece a los metales de transición, en la tabla periódica está en el 6. Subgrupo (grupo 6) o grupo cromo. Los compuestos de cromo tienen muchos colores diferentes y a menudo se usan como pigmentos en pinturas y barnices.
recuperación
El mineral de cromita extraído se libera de la roca muerta. En el segundo paso, se lleva a cabo una digestión oxidante a aproximadamente 1200 ° C para dar el cromato:
El cromato de sodio se extrae con agua caliente y se convierte en dicromato con ácido sulfúrico:
El dicromato de sodio cristaliza al enfriarse como un dihidrato de la solución. Una reducción posterior con carbono da óxido de cromo (III):
A esto le sigue la reducción aluminotérmica del óxido de cromo (III) a cromo:
El cromo no se puede obtener a partir de minerales oxídicos por reducción con carbón, ya que esto da como resultado carburo de cromo. El cromo más puro se produce por electrodeposición del Cr3+Se muestran iones de la solución de ácido sulfúrico. Las soluciones correspondientes se preparan disolviendo óxido de cromo (III) o ferrocromo en ácido sulfúrico. Sin embargo, el ferrocromo como material de partida requiere una separación previa del hierro.
El cromo extremadamente puro se produce mediante pasos de purificación adicionales utilizando el proceso de van Arkel de Boer.
El ferrocromo se produce reduciendo la cromita en un horno de arco eléctrico a 2800 ° C.
Propiedades
El cromo es un metal duro de color blanco plateado, resistente a la corrosión y al deslustre que es duro, maleable y forjable en su estado original. Es antiferromagnético con una temperatura de Néel de 475 K.[ 11 ] El cromo se disuelve en ácido clorhídrico y ácido sulfúrico después de algún tiempo con desprendimiento de hidrógeno cuando la capa protectora de óxido desaparece. Los niveles de oxidación comunes del cromo son +2, +3 y +6, siendo +3 el más persistente.
Cr (II) es d4-Configuración inestable. Apenas existe otro agente reductor que absorba el oxígeno del aire tan rápidamente como el Cr (II). Pero incluso sin admisión de aire, Cr2+-Las soluciones solo son estables por poco tiempo si se obtienen del cromo más puro (por ejemplo, cromo electrolito).
Cr3+ es la forma más estable. Esto se explica por la teoría del campo cristalino, según la cual el d3 La configuración se estabiliza mediante una carcasa inferior medio llena.
Cr (VI) como cromato (CrO42-) o dicromato (Cr2O72-) se utiliza como un fuerte agente oxidante. Es tóxico y cancerígeno. En soluciones acuosas, existe un equilibrio químico entre los dos iones que depende del pH. Si acidifica una solución diluida de cromato amarillo, administra H.+-Iones además, según LeChatelier el equilibrio se desplaza en la dirección del dicromato, la solución se vuelve naranja.

- Instrucciones de seguridad y significado biológico.
El papel de Cr (III) (Cr3+Iones) en el cuerpo humano es actualmente objeto de controversia. Hay indicios de que el Cr (III) podría tener un papel en el metabolismo de los carbohidratos y las grasas de los mamíferos. Actualmente se está realizando un seguimiento de esta información. Las indicaciones anteriores de que el popular suplemento dietético Cr (III) -picolinato tiene una influencia beneficiosa sobre la estructura corporal no pudieron confirmarse en estudios posteriores. Un estudio con células de hámster mostró que el picolinato de Cr (III) es mutagénico y puede causar cáncer.
Los datos actualmente disponibles indican que es extremadamente improbable que sufra una deficiencia de cromo. Incluso dosis más altas de Cr (III) desencadenan un efecto tóxico con dificultad, ya que el producto de solubilidad del hidróxido de Cr (III) es extremadamente bajo (6,7 x 10-31). Por tanto, es de suponer que es muy difícil de absorber en el intestino humano. En los EE.UU., el nivel de ingesta recomendado de Cr (III) se ha reducido de 50 a 200 µg / día a 35 µg / día en hombres adultos y a 25 µg / día en mujeres adultas.
Los compuestos de Cr (VI) son extremadamente tóxicos. Son mutagénicos y dañan el ADN. Ingresan al cuerpo a través de las vías respiratorias y dañan el tejido pulmonar. Las personas expuestas de forma crónica a dichos compuestos tienen un mayor riesgo de desarrollar cáncer de pulmón. El efecto venenoso aumenta con la insolubilidad de la sal. La directiva RoHS restringe severamente el uso de compuestos de Cr (VI) en Europa.
Utilizar
El cromo y los compuestos de cromo se usan en una amplia variedad de aplicaciones donde se usa su durabilidad:
- cromado duro: aplicación galvánica de una capa de protección contra el desgaste de hasta 1 mm de espesor directamente sobre acero, hierro fundido, cobre. El aluminio también se puede cromar después de aplicar una capa intermedia (cilindros de aluminio cromado duro en la construcción del motor).
- Dekorverchromung: Aplicación galvánica de una capa de Cr de espesor <1 μm como decoración con una capa intermedia anticorrosión de níquel o níquel-cobre. Las piezas de plástico también suelen estar cromadas. El proceso de acrolito es un sustituto del cromado decorativo.
- pasivación capas de zinc galvánico (cromado)
- elemento de aleación: en aceros inoxidables resistentes al calor y a la corrosión y aleaciones no ferrosas
- Catalizador: para permitir o acelerar las reacciones químicas
- curtido al cromo: el método principal para hacer cuero
Conexiones
- El óxido de cromo
- Óxido de cromo (III) Cr2O3, se utiliza como pintura de esmalte y para colorear vidrio (botellas verdes) (también verde puente de Colonia). Esto no debe confundirse con el verde cromo tóxico.
- amarillo de cromo
- Plomo (II) cromato PbCrO4, utilizado para servir como un pigmento de color amarillo brillante ("Post amarillo"). Debido a su toxicidad, ahora se reemplaza casi por completo por pigmentos de color orgánicos. En análisis se utiliza para la determinación yodométrica de plomo.
El amarillo de cromo, que se utiliza como pintura de artista, es un sulfato de plomo / cromato de plomo (aproximadamente 2 PbSO4 · PbCrO4). El pigmento fue descubierto por Louis-Nicolas Vauquelin en 1809 y se produce comercialmente en Alemania desde 1820. El amarillo cromo tiene un alto poder cubriente, su estabilidad a la luz depende del tono amarillo. El amarillo cromo rara vez se usa en pintura al óleo. Vincent van Gogh, sin embargo, usó amarillo cromo a. a. en las famosas pinturas de girasoles ejecutadas en óleo sobre lienzo. Hoy, sin embargo, algunos de ellos sufren decoloración de los tonos amarillos.
El tecnólogo de arte Prof.Christoph Krekel de la Academia de Arte de Stuttgart sobre el uso del pigmento amarillo de cromo: "Los pintores han caído sobre el amarillo cromo, porque es un amarillo muy brillante, tiene una gran intensidad de color, es decir, podría crear una pintura mucho más brillante con la ayuda de este nuevo tono amarillo".
El amarillo cromo también es un color importante en el análisis de falsificación de pinturas "antiguas".
- dióxido de cromo
- Óxido de cromo (IV) CrO2, es un polvo ferromagnético negro para la producción de cintas magnéticas con una mejor relación señal-ruido que las cintas magnéticas de óxido de hierro convencionales porque el dióxido de cromo tiene una mayor coercitividad.
- ácido crómico
- con la estructura hipotética H2CrO4 existe solo en solución acuosa diluida. Es muy venenoso. Existe como anión en algunos cromatos y dicromatos.
El anhídrido del ácido crómico, el muy venenoso óxido de cromo (VI) CrO3, se conoce como trióxido de cromo.
El dicromato de potasio K anaranjado, muy venenoso2Cr2O7 es un poderoso agente oxidante: en una solución de ácido sulfúrico, los alcoholes primarios se convierten fácilmente en los respectivos aldehídos, que se pueden utilizar para la detección semicuantitativa de alcohol en el aliento. En el laboratorio estaba en forma de ácido crómico utilizado para limpiar cristalería. Sin embargo, al entrar en contacto con iones de cloruro, el volátil, cancerígeno cromilo CrO2Cl2 formado (¡deducción!). El dicromato de potasio también se utiliza como titulante y como fijador en baños de tintes industriales. Dicromato de potasio y el también muy venenoso dicromato de amonio (NH4)2Cr2O7 son la sustancia sensible a la luz en las capas de gelatina de cromo de las primeras fotografías (consulte el proceso de impresión fina).
- cromita
- (Ladrillo de hierro cromado, ver arriba) FeCr2O4 se usa para hacer moldes para quemar ladrillos.
Precios, gráficos y datos históricos del cromo
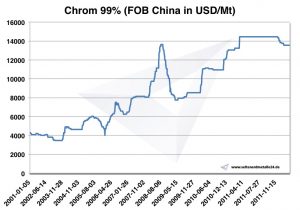
Gráfico Chrome 2001-2011








 = 3,1 10-4)
= 3,1 10-4)


