Indio, In, número atómico 49
Precio del indio, ocurrencia, extracción y uso
General
El indio es un elemento químico con el símbolo In y el número atómico 49. En la tabla periódica de los elementos está en el quinto período y es el cuarto elemento del tercer grupo principal (grupo 5 según el nuevo recuento) o grupo de boro. El indio es un metal pesado raro, blanco plateado y blando. Su abundancia en la corteza terrestre es comparable a la de la plata. El indio no es esencial para el cuerpo humano, ni se conocen efectos tóxicos. La mayor parte del metal se procesa ahora en óxido de indio y estaño, que se utiliza como conductor transparente para pantallas planas y pantallas táctiles. Desde el cambio de milenio, el aumento de la demanda asociado ha llevado a un aumento significativo en los precios del indio y a discusiones sobre el rango de los depósitos.
El indio fue descubierto en 1863 por los químicos alemanes Ferdinand Reich y Theodor Richter en la Bergakademie Freiberg. Examinaron una muestra de esfalerita encontrada en el área en busca de talio. En lugar de las esperadas líneas de talio, encontraron una línea espectral azul índigo previamente desconocida en el espectro de absorción y, por lo tanto, un elemento previamente desconocido. El nuevo elemento recibió posteriormente su nombre. Poco tiempo después, inicialmente pudieron producir cloruro y óxido de indio, y el metal reduciendo el óxido de indio con hidrógeno. Una gran cantidad de indio se mostró por primera vez en la Exposición Mundial de París en 1867.
Después de su primer uso en 1933 como componente de aleación en oro dental, el uso extensivo del indio comenzó con la Segunda Guerra Mundial. Estados Unidos lo utilizó como revestimiento en cojinetes de aviones sometidos a grandes esfuerzos. Después de la Segunda Guerra Mundial, el indio se utilizó principalmente en la industria electrónica, como material de soldadura y en aleaciones de bajo punto de fusión. El uso en barras de control de reactores nucleares también se volvió importante con el uso creciente de energía nuclear. Esto condujo al primer aumento brusco del precio del indio en 1980. Sin embargo, después del accidente nuclear de Three Mile Island, tanto la demanda como el precio cayeron significativamente.
A partir de 1987 se desarrollaron dos nuevos compuestos de indio, el fosfuro de indio semiconductor y el óxido de estaño indio transparente, que es conductor y transparente en capas delgadas. El óxido de indio y estaño, en particular, se volvió técnicamente interesante con el desarrollo de pantallas de cristal líquido. Debido a la gran demanda, la mayor parte del indio se ha transformado en óxido de indio y estaño desde 1992.
Ocurrencia
El indio es un elemento raro, su participación en la corteza continental es de solo 0,05 ppm. Por lo tanto, tiene una frecuencia similar a la de la plata y el mercurio. En su estado sólido, el indio solo se ha encontrado en un único hallazgo en el este de Siberia. Solo se conocen unos pocos minerales de indio. Se trata principalmente de minerales sulfídicos como Indit FeIn2S4 y Roquésit CuInS2. Sin embargo, estos son raros y no juegan un papel en la producción de indio. Los mayores depósitos de indio se encuentran en minerales de zinc, especialmente esfalerita. Las reservas teóricas se estiman en 16.000 toneladas, de las cuales alrededor de 11.000 toneladas son económicamente explotables. Los depósitos más grandes se encuentran en Canadá, China y Perú. Los minerales que contienen indio también se encuentran en Australia, Bolivia, Brasil, Japón, Rusia, Sudáfrica, Estados Unidos, Afganistán y algunos países europeos. En Alemania hay depósitos en los Montes Metálicos (Freiberg, Marienberg, Geyer) y en Rammelsberg en los Montes Harz.
Extracción y presentación.
El indio se obtiene casi exclusivamente como subproducto de la producción de zinc o plomo. La extracción económica es posible si el indio se acumula en ciertos puntos del proceso de producción. Estos incluyen polvos de combustión que se generan durante el tostado de sulfuro de zinc y residuos que quedan durante la electrólisis durante el proceso húmedo de producción de zinc. Estos se hacen reaccionar con ácido sulfúrico o ácido clorhídrico y así se disuelven. Dado que la concentración de indio en el ácido es demasiado baja, debe enriquecerse. Esto se realiza, por ejemplo, mediante extracción con tributilfosfato o precipitación como fosfato de indio.
La producción real de indio se realiza electrolíticamente. Para ello se utiliza una solución de cloruro de indio (III) en ácido clorhídrico. Este se convierte en indio elemental con la ayuda de electrodos de mercurio. Durante la electrólisis, se debe tener cuidado de que la solución ya no contenga talio, ya que los potenciales estándar de los dos elementos son muy similares.

El producto crudo puede purificarse adicionalmente por medio de procesos adecuados tales como procesos de fusión por zonas o electrólisis repetida de sales de cloruro de indio (I) fundidas y así se puede obtener más de 99,99% de indio puro.
Producción
La producción primaria (producción minera) de indio fue entre 2006 en el año 500 y 580 toneladas. Debido a las bajas reservas naturales de 11.000 toneladas y la alta demanda, el indio es una de las materias primas más escasas del mundo. En 2008, la información sobre las reservas naturales de indio para China en particular creció de 280 a 8.000 toneladas, lo que aumentó el rango estático de 6 a 19 años. La producción secundaria, es decir, el reciclaje, supera la producción primaria y fue de 2008 toneladas en 800.
La producción de indio en China solo ha aumentado recientemente. En 1994 la cantidad producida era todavía de 10 toneladas. Desde entonces, la participación de China en la producción mundial ha aumentado al 60% en 2005. La producción en otros países como Japón, Canadá o Francia solo pudo incrementarse en pequeña medida o disminuir debido al agotamiento de los depósitos. En 2006, por ejemplo, se cerró la mina japonesa Toyoha, lo que redujo significativamente la producción allí.
Dado que la demanda de indio ha crecido más rápido que la producción, el precio del indio aumentó bruscamente de $ 97 en 2002 a $ 827 por kilogramo en 2005. El indio se recicla principalmente reciclando los residuos de la pulverización catódica. El único país donde actualmente se recupera indio en grandes cantidades es Japón.
Si la demanda continúa aumentando y el precio sube, el reciclaje de materiales con solo una pequeña cantidad de indio será rentable. Del mismo modo, tiene sentido económico explotar minerales con bajos contenidos de indio. Esto probablemente hará posible retrasar el agotamiento de los recursos.
El indio puede ser reemplazado por otras sustancias en la mayoría de las aplicaciones, pero esto a menudo empeora las propiedades del producto o la rentabilidad de la producción. Por ejemplo, el fosfuro de indio se puede reemplazar por arseniuro de galio, y son posibles algunos sustitutos del óxido de indio y estaño, aunque de peor calidad.
Propiedades
Propiedades fisicas
| sistema cristalino | tetragonal |
| grupo espacial |  |
| parámetros de red
(Celda unidad) |
a = (b) = 325 pm
c = 495 pm |
| Número (Z) de
unidades de fórmula |
Z = 2 |

Celda unitaria de indio con entorno de coordinación del átomo de indio central

Poliedro de coordinación de un átomo de indio formado por 4 + 8 = 12 átomos vecinos en forma de cuboctaedro distorsionado
El indio es un metal blanco plateado con un bajo punto de fusión de 156,5985 ° C. Entre los metales, solo el mercurio, el galio y la mayoría de los metales alcalinos tienen un punto de fusión más bajo. El metal es líquido en un rango muy amplio de casi 2000 K. El indio líquido deja permanentemente una fina película sobre el vidrio (humectación). El galio similar tiene la misma propiedad.
El metal tiene una alta ductilidad y una dureza muy baja (dureza de Mohs: 1,2). Por tanto, es posible cortar indio como sodio con un cuchillo. Al mismo tiempo, deja una línea visible en el papel. El indio es superconductor por debajo de una temperatura de transición de 3,41 Kelvin. Una peculiaridad del indio, que tiene en común con el estaño, son los ruidos característicos que se oyen cuando se dobla el indio (“gritos del peltre”).
Solo se conoce una modificación cristalina del indio en condiciones normales, que en el sistema de cristal tetragonal en el grupo espacial  y así en una cuadrícula tetragonal centrada en el cuerpo con los parámetros de la cuadrícula a = 325 pm y c = 495 pm y dos unidades de fórmula cristalizan en la celda unitaria.
y así en una cuadrícula tetragonal centrada en el cuerpo con los parámetros de la cuadrícula a = 325 pm y c = 495 pm y dos unidades de fórmula cristalizan en la celda unitaria.
Un átomo de indio está rodeado por otros doce átomos en la estructura cristalina, cuatro de los cuales provienen de las celdas unitarias vecinas y están más juntos (325 pm; enlaces rojos) que los ocho átomos en las esquinas de la celda unitaria (337 pm; enlaces verdes). El número de coordinación 4 + 8 = 12 da como resultado un cuboctaedro distorsionado como poliedro de coordinación. Por lo tanto, la estructura cristalina se puede describir como un empaquetamiento de esferas cúbico más próximo, distorsionado tetragonalmente.
En experimentos de alta presión, se descubrió otra modificación que es estable por encima de 45 GPa y en el sistema de cristales ortorrómbicos en el grupo espacial FMMM cristalizado.
Propiedades quimicas
Las propiedades químicas del indio son similares a las de su grupo vecino, el galio y el talio. Como los otros dos elementos, el indio es un elemento base que puede reaccionar con muchos no metales a altas temperaturas. En el aire es estable a temperatura ambiente porque, al igual que con el aluminio, se forma una densa capa de óxido que protege el material de una mayor oxidación a través de la pasivación. La reacción al óxido de indio (III) solo tiene lugar a altas temperaturas.
Si bien el indio es atacado por ácidos minerales como el ácido nítrico o el ácido sulfúrico, no es soluble en agua caliente, álcalis y la mayoría de los ácidos orgánicos. Incluso el agua salada no ataca al indio. El indio es el metal más soluble en mercurio a temperatura ambiente.
isótopo
Hay 38 isótopos diferentes y otros 45 isómeros centrales de indio. 97En a 135En conocido. Solo dos isótopos ocurren en la naturaleza, 113In (64 neutrones) con 4,29% y 115En (66 neutrones) con una participación del 95,71% en la distribución de isótopos naturales. El isótopo común 115Es débilmente radiactivo, es un emisor beta con una vida media de 4,41 · 1014 Años. Ambos isótopos naturales se pueden detectar con la ayuda de la espectroscopia de RMN. Los isótopos artificiales más estables 111En y 114mEn tener vidas medias de varios días, 113mEn solo una hora y media. 111En y 113mSe utilizan en medicina nuclear.
Utilizar
Metal

El alambre de indio se utiliza en sellos de indio.
El indio es versátil, pero su uso está limitado por su rareza y alto precio. La mayor parte del indio producido no se utiliza como metal, sino que se procesa en una serie de compuestos. Para la producción de óxido de indio y estaño solo, el 2000% de la producción total de indio se utilizó en 65. Otros compuestos como el fosfuro de indio y el arseniuro de indio también se obtienen del indio producido. Se pueden encontrar más detalles sobre el uso de compuestos de indio en la sección Conexiones.
Las piezas de trabajo metálicas pueden protegerse mediante recubrimientos de indio depositados galvánicamente. Los materiales de acero, plomo o cadmio, por ejemplo, revestidos de esta forma son más resistentes a la corrosión por ácidos orgánicos o soluciones salinas y, sobre todo, a la abrasión. En el pasado, las capas protectoras de indio se usaban a menudo para cojinetes deslizantes en automóviles o aviones. Sin embargo, desde el fuerte aumento del precio del indio, esto ya no es económico. Las superficies recubiertas con indio tienen un grado de reflexión alto y uniforme en todos los colores y, por lo tanto, se pueden utilizar como espejo.
El punto de fusión del indio es relativamente bajo y se puede determinar con mucha precisión. Por este motivo, es uno de los puntos fijos a la hora de configurar la escala de temperatura. Esta propiedad también se utiliza para la calibración en calorimetría diferencial dinámica (DSC).
Debido a la gran sección transversal de captura para neutrones rápidos y lentos, el indio es un material adecuado para barras de control en reactores nucleares. Las láminas de indio también se pueden utilizar como detectores de neutrones. El indio es hermético a los gases y fácil de deformar incluso a bajas temperaturas, por lo que se utiliza en los denominados cierres de indio en criostatos.
El indio también juega un papel como soldadura para muchos materiales debido a algunas propiedades especiales. Solo se deforma ligeramente cuando se enfría. Esto es especialmente importante al soldar semiconductores para transistores. El hecho de que el indio también pueda soldar materiales no metálicos como el vidrio y la cerámica también influye.
Con “píldoras de indio”, se alearon plaquetas de germanio en ambos lados para producir los primeros transistores.
aleaciones
El indio se puede alear con muchos metales. Muchas de estas aleaciones, especialmente con los metales bismuto, estaño, cadmio y plomo, tienen un punto de fusión bajo de 50 a 100 ° C. Esto da lugar a posibles aplicaciones en sistemas de rociadores, termostatos y fusibles, por ejemplo. Dado que el plomo, que también se puede utilizar, es venenoso, el indio sirve como sustituto inofensivo. El propósito de estas aleaciones es que se fundan cuando la temperatura ambiente es demasiado alta, provocada por fuego o corrientes elevadas. Luego, la fusión interrumpe el circuito o activa el sistema de rociadores. Las aleaciones de indio-galio a menudo tienen puntos de fusión aún más bajos y están contenidas en termómetros de alta temperatura. Una aleación especial de galio-indio-estaño es Galinstan. Es líquido a temperatura ambiente y sirve como un sustituto inofensivo del mercurio o las aleaciones de sodio y potasio.
Hay varias otras aleaciones que contienen indio que se utilizan en diferentes áreas. El indio se utiliza con cobre, manganeso y magnesio como componente de aleación en materiales magnéticos. Ocasionalmente, se utiliza indio (máximo 5%) con plata, estaño, cobre, mercurio y zinc como mezcla en los empastes de amalgama. La capa de almacenamiento de un CD-RW contiene indio, entre otras cosas.
prueba
Una posible prueba química es la precipitación de iones de indio con la ayuda de 8-hidroxiquinolina de una solución de ácido acético. Normalmente, el indio no se detecta químicamente, pero utilizando métodos espectroscópicos adecuados. El indio se puede detectar fácilmente utilizando las líneas espectrales características a 451,14 nm y 410,18 nm. Dado que se encuentran en el rango espectral azul, se obtiene el típico color de llama azul. El análisis de fluorescencia de rayos X y la espectrometría de masas están disponibles como métodos de examen para una determinación cuantitativa más precisa.
Toxicidad y seguridad.
Si bien no se sabe que el metal indio tenga efectos tóxicos, se ha demostrado que los iones de indio tienen efectos embrionarios y teratogénicos en experimentos con animales con ratas y conejos. Con una dosis única de 0,4 mg * kg-1 InCl _3 Se han observado malformaciones como paladar hendido y oligodactilia en ratas preñadas. Estos fenómenos se encontraron con mayor frecuencia cuando se aplicó el indio al décimo día de gestación. Por el contrario, no se observaron malformaciones en ratones. Se ha encontrado que el nitrato de indio es tóxico para los organismos acuáticos (toxicidad acuática).
El metal indio compacto no es inflamable. En el estado finamente dividido como polvo o polvo, por otro lado, como muchos metales, es altamente inflamable y combustible. El indio en combustión no debe extinguirse con agua debido al riesgo de explosión por el hidrógeno producido, sino que debe extinguirse con extintores metálicos (clase D).
Conexiones
El indio forma varios compuestos. En ellos, el metal suele tener el estado de oxidación + III. El nivel + I es más raro e inestable. El estado de oxidación + II no existe, los compuestos en los que se encuentra el indio formalmente divalente son en realidad compuestos mixtos de indio monovalente y trivalente.
indio
El óxido de indio (III) es una sal estable de color amarillo. El óxido de indio (III) puro rara vez se usa; en tecnología, la mayor parte se procesa aún más en óxido de indio y estaño. Es óxido de indio (III) dopado con una pequeña cantidad de óxido de estaño (IV). Esto convierte la conexión en un óxido transparente y conductor (material TCO). Esta combinación de propiedades, que solo tienen algunos otros materiales, significa que es ampliamente utilizado. El óxido de indio y estaño se utiliza en particular como conductor en pantallas de cristal líquido (LCD), diodos emisores de luz orgánicos (OLED), pantallas táctiles y células solares. En otras aplicaciones, como ventanas de automóviles con calefacción y celdas solares, el costoso óxido de indio y estaño podría reemplazarse por un óxido de zinc dopado con aluminio más barato.
semiconductor compuesto
Muchos compuestos de indio son semiconductores compuestos con espacios de banda característicos. Esto se aplica en particular a compuestos con elementos del 15º y 16º grupo principal, como fósforo, arsénico o azufre. Aquellos con elementos del 15º grupo principal se cuentan entre los semiconductores compuestos III-V, aquellos con calcógenos entre los semiconductores compuestos III-VI. El número depende del número de electrones de valencia en los dos componentes de conexión. El nitruro de indio, el fosfuro de indio, el arseniuro de indio y el antimonuro de indio tienen diferentes aplicaciones en diferentes diodos, como los diodos emisores de luz (LED), fotodiodos o diodos láser. La aplicación exacta depende de la banda prohibida requerida. Sulfuro de indio (III) (en2S3) es un semiconductor III-VI con una banda prohibida de 2 eV, que se utiliza en lugar de las células solares de sulfidina de cadmio. Algunos de estos compuestos, en particular el fosfuro de indio y el arseniuro de indio, desempeñan un papel en la nanotecnología. Los nanocables de fosfuro de indio tienen una fotoluminiscencia fuertemente anisotrópica y posiblemente se pueden usar en fotodetectores o interruptores ópticos altamente sensibles.
Además de los semiconductores compuestos simples, también hay compuestos semiconductores que contienen más de un metal. Un ejemplo es el arseniuro de galio indio (enxGa1-xAs) un semiconductor ternario con un intervalo de banda reducido en comparación con el arseniuro de galio. Diselenuro de cobre e indio (CuInSe2) tiene un alto grado de absorción de luz y, por lo tanto, se utiliza en células solares de película fina (células solares CIGS).
Otros compuestos de indio
El indio forma una serie de compuestos con los halógenos flúor, cloro, bromo y yodo. Son ácidos de Lewis y forman complejos con donantes adecuados. Un haluro de indio importante es el cloruro de indio (III). Este se utiliza, entre otras cosas, como catalizador para la reducción de compuestos orgánicos.
También existen compuestos orgánicos de indio con las fórmulas generales InR3 e InR. Como muchos compuestos organometálicos, son sensibles al oxígeno y al agua. Los compuestos orgánicos de indio se utilizan como reactivos de dopaje en la producción de semiconductores.
| General | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre, símbolo, número atómico | Indio, In, 49 | |||||||||||||||||||||||||||||||||
| serie | metales | |||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 13, 5, p | |||||||||||||||||||||||||||||||||
| Apariencia | gris plateado brillante | |||||||||||||||||||||||||||||||||
| CAS | 7440-74-6 | |||||||||||||||||||||||||||||||||
| Fracción de masa de la capa de tierra | 0,1 ppm | |||||||||||||||||||||||||||||||||
| nuclear | ||||||||||||||||||||||||||||||||||
| masa atómica | 114,818 u | |||||||||||||||||||||||||||||||||
| Radio atómico (calculado) | 155 (156) pm | |||||||||||||||||||||||||||||||||
| Radio covalente | . | |||||||||||||||||||||||||||||||||
| Van der Waals radio | . | |||||||||||||||||||||||||||||||||
| configuración electrónica | [Kr] 4d105s25p1 | |||||||||||||||||||||||||||||||||
| 1. ionización | 558,3 kJ / mol | |||||||||||||||||||||||||||||||||
| 2. ionización | 1820,7 kJ / mol | |||||||||||||||||||||||||||||||||
| 3. ionización | 2704 kJ / mol | |||||||||||||||||||||||||||||||||
| físicamente | ||||||||||||||||||||||||||||||||||
| estado físico | fest | |||||||||||||||||||||||||||||||||
| estructura cristalina | tetragonal | |||||||||||||||||||||||||||||||||
| densidad | 7,31 g / cm3 | |||||||||||||||||||||||||||||||||
| dureza de Mohs | 1,2 | |||||||||||||||||||||||||||||||||
| magnetismo | diamagnético = -5,1 10-5) = -5,1 10-5) |
|||||||||||||||||||||||||||||||||
| punto de fusión | 429,7485[ 4 ] K (156,5985 ° C) | |||||||||||||||||||||||||||||||||
| punto de ebullición | 2345 K (2072 ° C) | |||||||||||||||||||||||||||||||||
| Volumen molar | 15,76 · 10-6 m3/ mol | |||||||||||||||||||||||||||||||||
| El calor de vaporización | 231,8 kJ / mol | |||||||||||||||||||||||||||||||||
| calor de fusión | 3,26 kJ / mol | |||||||||||||||||||||||||||||||||
| presión de vapor | 1 Pa a 1196 K | |||||||||||||||||||||||||||||||||
| velocidad del sonido | 1215 m / s en 293,15 K | |||||||||||||||||||||||||||||||||
| Capacidad calorífica específica | 233 J / (kg · K) | |||||||||||||||||||||||||||||||||
| Conductividad electrica | 12,5 · 106 A / (V · m) | |||||||||||||||||||||||||||||||||
| conductividad térmica | 81,6 W / (m K) | |||||||||||||||||||||||||||||||||
| Químico | ||||||||||||||||||||||||||||||||||
| estados de oxidación | 3, 1 | |||||||||||||||||||||||||||||||||
| potencial normales | −0,343 V (en3+ + 3e- → En) | |||||||||||||||||||||||||||||||||
| electronegatividad | 1,78 (escala Pauling) | |||||||||||||||||||||||||||||||||
| isótopo | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| propiedades de RMN | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| seguridad | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
Precio del indio
Precios del indio -> Precios estratégicos de los metales
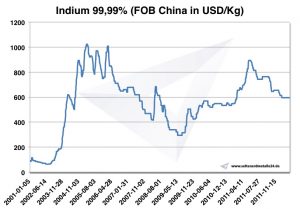
Gráfico Indium 2001-2011



