Bismuto, Bi, número atómico 83
Bismuto - Historia, ocurrencia, extracción, usos y precios del bismuto
El bismuto o bismuto (obsoleto también: bismuto) es un elemento químico con el símbolo del elemento Bi y el número atómico 83. En la tabla periódica está en el 5. Grupo principal o grupo nitrógeno.
No se conoce un isótopo estable. Sin embargo, la extremadamente baja vida media extremadamente baja radiactividad del 209Bi natural es irrelevante para uso práctico. La radiactividad se pudo detectar solo 2003, ya que anteriormente no se disponía de los métodos de medición altamente sensibles necesarios; 1990Bi fue considerado el nucleido estable más pesado en los años 209.
Historia
Como elemento separado, el bismuto se convirtió en el centro de 18. Siglo de los químicos Claude Francois Geoffroy, Johann Heinrich Pott, Carl Wilhelm Scheele y Torbern Olof Bergman demostraron. Anteriormente, a menudo se consideraba un derivado del plomo, el estaño, el antimonio y otros metales o minerales. En el libro Un libro de montaña útil (sobre 1527), el mineral de Bismuto (wissmad arzcz) se menciona como un compañero de mineral de plata. Más tarde en el 16. Century Georgius Agricola intentó una distinción más precisa.
El nombre del metal, que aparece como wesemut en el alemán 1390 y lat. 1450 como wismutum, 1530 como bisemutum, se puede encontrar en la traducción árabe de Dioscuri de 9. Se debe atribuir la forma documentada del siglo b [i] sīmūtīyūn, que es probablemente una transcripción del griego antiguo ψιμύθιον psimýthion, representa el plomo blanco '. La génesis del árabe iṯmid, antimonio 'también fue adoptada; A menudo, además del supuesto primer motín en la mina St. Georgen en los prados cerca de Schneeberg en Erzgebirge en 15. Siglo, o en la variante wis (se) mat. que significa "masa blanca".
El símbolo químico Bi fue sugerido por JJ Berzelius en el año 1814.
Ocurrencia
El bismuto se produce naturalmente en la naturaleza, es decir, en forma elemental, y es reconocido como mineral por la Asociación Internacional de Mineralogía (IMA). El 9 utilizado por la IMA. Edición de la clasificación de minerales después de que Karl Hugo Strunz lidera el bismuto junto con antimonio, arsénico y estibarsen en la subdivisión de los elementos de arsénico bajo el sistema no. 1.CA.05 (edición 8 obsoleta: I / B.01-40). En la clasificación predominantemente usada en inglés de minerales según Dana Bismuth pertenece al "grupo de arsénico" con el sistema no. 01.03.01.
El bismuto sólido se forma en vetas hidrotermales de pegmatitas y venas de cuarzo de estaño y tungsteno que contienen topacio y generalmente junto con varios minerales de cobre, níquel, plata y estaño. El bismuto rara vez desarrolla formas de cristal bien formadas, pero puede alcanzar un tamaño de hasta 12 centímetros. Por lo general, se encuentra en forma de agregados dendríticos, laminares o granulares, pero también como gemelos polisintéticos con estrías paralelas ("bismuto de primavera") o superficies laterales en forma de embudo dibujadas en el centro del cristal.
Hasta ahora (a partir de 2011) se conocen ubicaciones de 1400 para bismuto sólido. Los sitios se encuentran principalmente en Australia, Bolivia, China, Canadá, México, Perú y España, históricamente en Bieber en Spessart y en los Montes Metálicos, donde el bismuto en forma pura y como sulfuro (bismuthita), seleniuro (brillo de bismuto de seleniuro) y óxido ( Bismit) se encuentra. Además, el bismuto, así como el antimonio y el arsénico, se presenta ocasionalmente como un sulfuro doble: galenobismuthita (PbBi2S4), lillianita (Pb3Bi2S6), bismuto de plata (AgBiS2), cobre bismuto (XXXX). También se conoce un sulfuro de telurio en forma de Tellurbismut (Bi2Te6S) y un silicato llamado Eulytin (Bi2 (SiO6) 2).
En general, se conoce el bismuto sólido alrededor de los minerales de bismuto 230.
Extracción y presentación.
Para la producción de bismuto se pueden asumir minerales oxídicos o sulfídicos.
Los minerales de óxido se reducen a bismuto en hornos de carbón:
Las sales de sulfuro de bismuto se pueden reducir con hierro mediante el método de precipitación:
O los minerales sulfídicos se convierten primero en los óxidos y luego se reducen con carbón (método de reducción de Röder):
El bismuto crudo se elimina mediante la fusión oxidante de otros elementos (antimonio, arsénico, plomo, hierro y azufre). El cobre se elimina fundiendo con sulfuro de sodio, oro y plata mediante la extracción de bismuto fundido con estaño.
Propiedades
Propiedades fisicas
El bismuto es un metal o semimetal cristalino blanco plateado, quebradizo y grueso con un toque de rosa. Tiene una estructura de cristal romboédrica con bicapas muy densamente empaquetadas. La distancia más corta entre dos capas dobles es 352,9 pm, que es solo 15% más grande que la distancia más pequeña entre dos átomos dentro de una capa doble. Los monocristales de bismuto muestran una división pronunciada paralela a estas bicapas.
El bismuto tiene el efecto Hall más fuerte de todos los elementos metálicos y, como un semi-metal en forma pura, una conductividad eléctrica deficiente. Muestra, aparte de los superconductores y el grafito pirolítico, más allá de la propiedad diamagnética más fuerte, se expulsa de un campo magnético aplicado externamente. El efecto Schubnikow-de-Haas (oscilaciones de resistencia eléctrica en un campo magnético externo) se observó por primera vez en cristales de bismuto y se midió. Antes del desarrollo de los sensores Hall y las placas de campo, se utilizaba la llamada espiral de bismuto, una bobina con alambre de bismuto aislado delgado y enrollado, para medir campos magnéticos. El cambio de resistencia de la bobina bajo la influencia de un campo magnético cambiante fue ciertamente muy pequeño en comparación con los sensores actuales.
Hay dos modificaciones conocidas del bismuto: el bismuto, que es común a temperatura ambiente, forma una estructura cristalina cúbica centrada en el cuerpo a alta presión (a partir de 9 GPa).
El bismuto líquido se expande como una de las pocas sustancias cuando se solidifica (anomalía de densidad). Este fenómeno también se observa en galio, germanio, plutonio, silicio, teluro y agua. Se basa en el bismuto que se produce una transición de doble fase durante la fusión (y la solidificación): una vez que la transición de fase 1. Ordene de sólido a líquido (generalmente con una pequeña disminución en la densidad) y además una transición de fase 1. Orden de metaloide a metal con un aumento considerable de densidad, lo que también explica la entropía de fusión inusualmente grande de 21,1 J / (K · mol) y el aumento repentino de la conductividad eléctrica de la masa fundida de bismuto.
Propiedades quimicas
El bismuto es resistente al aire seco a temperatura normal. En el aire húmedo, sin embargo, se forma una capa de óxido en la superficie. Además, el bismuto es resistente al agua y a los ácidos no oxidantes (ácido clorhídrico y ácido sulfúrico diluido). En los ácidos oxidantes (ácido nítrico o ácido sulfúrico concentrado caliente) el bismuto se disuelve para formar sales de bismuto (BiX3). En forma de polvo, es un sólido inflamable, se puede encender fácilmente por una breve exposición a una fuente de ignición y continúa quemándose después de la extracción. El riesgo de ignición es mayor, cuanto más fina se distribuye la sustancia. El metal en forma compacta no es inflamable.
Cuando está al rojo vivo, el bismuto arde con una llama azulada hasta convertirse en un humo marrón-amarillo: óxido de bismuto (III) (Bi2O3).
Bajo calor, el bismuto se combina directamente con los halógenos, así como con azufre, selenio y teluro directamente. El bismuto no reacciona con nitrógeno y fósforo.
isótopo
El bismuto natural consiste solo en el isótopo 209Bi. En 2003, el Instituto de Astrofísica Espacial, Orsay, Francia, descubrió que este isótopo, que ha sido estable hasta la fecha, es un emisor alfa con una vida media de (1,9 ± 0,2) 1019 años (aproximadamente 19 billones de años). La descomposición muy lenta del 209Bi en 205Tl se basa, por un lado, en la proximidad inmediata al doble 208Pb mágico en el esquema isotópico y el hecho de que 209Bi en sí mismo es simplemente mágico. La larga vida media da como resultado una actividad de 0,0033 Bq / kg (correspondiente a una sola desintegración nuclear por cinco minutos y kilogramos).
209Bi es el penúltimo miembro de la serie Neptunium y, excepto 205Tl, el único que sigue siendo natural. Debido a que los nucleidos que están al comienzo de la serie Neptunium ahora se incuban en reactores nucleares, la cantidad de 209Bi en la Tierra aumenta con el tiempo.
Utilizar
El bismuto se utiliza como componente de aleación en aleaciones de bajo punto de fusión, por ejemplo, para el metal de Wood, que se funde a 70 ° C, para el metal de Rose con un punto de fusión de 98 ° C y para el metal de Lipowitz, que se funde a 60 ° C.
Uso técnico
La aleación Bismanol con manganeso es un fuerte imán permanente.
En las aleaciones de revestimiento (estañado por inmersión en caliente) para conectores solares, sirve como reemplazo del plomo.
Los cristales individuales de bismuto sintético con dimensiones de más de 20 centímetros y placas de bismuto policristalino se utilizan como filtros de neutrones para investigaciones de materiales en reactores de investigación.
El compuesto químico telururo de bismuto bombea energía térmica a los elementos Peltier.
El material de cambio de fase de algunos DVD-RAM contiene bismuto, consulte Tecnología de cambio de fase.
Algunas fuentes propagan el bismuto como un elemento de aleación en aceros de corte libre para reemplazar el plomo. Debería mejorar la maquinabilidad de estos aceros sin las propiedades ecológicas negativas del plomo. Sin embargo, desde el punto de vista de la metalurgia del acero, esto es desfavorable, ya que el bismuto prácticamente no puede eliminarse metalúrgicamente y luego aparece como un elemento de acompañamiento indeseable en los aceros producidos a partir de chatarra. En la industria electrónica, una aleación de estaño de bismuto se usa como sustituto (palabra clave RoHS) para soldaduras con plomo. La desventaja es que para Bismuth estaño se requiere un equipo de soldadura propio. La contaminación con plomo (p. Ej., Reparación de equipos antiguos) da como resultado un punto de fusión muy bajo, mientras que el uso de herramientas de aleación de estaño y plata conduce a altas temperaturas y a la contaminación de la herramienta de bismuto.
El óxido de bismuto se utiliza para la producción de vidrios ópticos, así como también ayudas de sinterización en cerámica técnica. También encuentra aplicación en forma de bismuto germinado como detector de centelleo en la tomografía por emisión de positrones (PET).
Se utilizó una aleación de plomo-bismuto en la Unión Soviética como refrigerante para reactores nucleares. Si bien es más eficaz que el enfriamiento por agua a presión convencional, esta aleación también es más difícil de manejar. La aleación se solidifica a una temperatura inferior a 125 ° C y puede causar daños importantes en el reactor. Dichos reactores se utilizaron, entre otros, en submarinos nucleares (por ejemplo, la clase submarina Alfa).
El bismuto también se usa como un sustituto de plomo no tóxico para la munición de escopeta. Sin embargo, esto no es muy común.
En el 16. Century se desarrolló en el sur de Alemania y Suiza, una técnica de pintura en la que el bismuto se usaba como revestimiento para cajas decorativas más pequeñas o cajas, en parte, también para altares de madera. Esta técnica se llama pintura de bismuto.
Uso en la industria química.
El óxido de cloruro de bismuto (BiOCl) se utiliza como pigmento perlado blanco plateado en cosméticos.
El vanadato de bismuto se usa como un pigmento amarillo verdoso altamente resistente en uso y encuentra z. B. en pinturas de alta calidad, pinturas en emulsión para uso en fachadas, plásticos y tintas de impresión.
Además, el bismuto se usa como catalizador en la industria química.
Uso Medicinal
Los compuestos de bismuto como dibismuth tris (tetraoxodialuminate), nitrato de bismuto (subnitrato de bismuto, nitrato de bismuto básico) se usan como parte de una terapia con antibióticos contra el uso del patógeno Helicobacter pylori, que puede causar úlceras en el estómago y el duodeno (terapia de erradicación). La aplicación es una denominada terapia cuádruple (terapia combinada de un inhibidor de la bomba de protones y una triple terapia de bismuto [sal de bismuto, tetraciclina, metronidazol].
Los compuestos de bismuto también se usan en parte en la diarrea como astringentes y reducen el olor en el mal aliento y la flatulencia. Además, algunos compuestos (por ejemplo, Bibrocathol) se usan como antisépticos.
Además, el bismuto se usa de forma diagnóstica en la tomografía por emisión de positrones en forma de germen de bismuto como material detector del aparato de tomografía.
Históricamente, el bismuto estaba al final de 19. Century como parte de los polvos para heridas (p. Ej. Dermatol) utilizados. Desde los años 1920, se ha utilizado como remedio para la sífilis. Sin embargo, ha sido completamente reemplazado por antibióticos modernos.
Las sales de bismuto también se han utilizado como agentes de contraste de rayos X para visualizar el tracto gastrointestinal (la llamada comida de bismuto). Aquí, la sal de bismuto fue reemplazada por sulfato de bario.
El galato de bismuto se usa en una formulación de ungüento para la piel Stolte, y la pomada se puede usar para tratar la piel inflamatoria en los bebés.
Vergiftung
La intoxicación por bismuto (bismutismo) es rara debido a la mala absorción en el tracto gastrointestinal. Es en gran medida similar al envenenamiento por mercurio. Típico es la aparición de bismuto bismuto gris pizarra (deposición de sulfuro de bismuto) en la mucosa oral con formación de mucosa oral (estomatitis) y gingivitis (con aflojamiento dental, pérdida), enteritis intestinal con diarrea y daño renal (nefropatía por bismuto).
prueba
El bismuto es detectado por el conducto de bismuto con tiourea. El fluoruro de sodio, el cloruro de sodio y el tartrato de sodio y potasio se utilizan para precipitar iones interferentes no deseados:
NaF para la complejación de Fe3 + y Al3 +
NaCl para la precipitación de Ag + y Hg22 +
Tartrato para la complejación de Sb3 + y Sn2 +
En presencia de Bi3 +, se forma un complejo cristalino de tiourea amarillo limón en el que tres moléculas de tiourea están asociadas con el bismuto a través del azufre:
![{\displaystyle {\ce {\rm {Bi^{3+}{+}3SCN2H4{->}[Bi(SCN2H4)3]^{3+}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c283de06adc520701a39cebdb2d9f9e206572f68)
Reacciones de detección alternativas:
En una reacción redox con iones de estaño (II) como agente reductor, el bismuto elemental precipita negro.
Con solución de yoduro de sodio: primero precipita el yoduro de bismuto negro (III), que luego se disuelve en exceso de yoduro como un complejo de tetrayodobismutato naranja:
![{\ Displaystyle {\ ce {\ rm {Bi ^ {3 +} {+} 4I ^ {-} {->} [BiI4] ^ {-}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f1a3e20448941130afb1ebcb56f6ed3bd093dad)
1,3,4-thiadiazole-2,5-dithiol también es adecuado como agente complejante para la detección.
Conexiones
El bismuto es principalmente trivalente, pero también hay un bismuto pentavalente; Sin embargo, el óxido de bismuto (V) es un agente oxidante muy fuerte que incluso oxida el manganeso (II) a permanganato. También forma cationes poliméricos. Es estable en el aire.
- compuestos oxigenados
Óxido de bismuto (III) (bismuto, también llamado heces de bismuto) - compuestos de azufre
Bismuto sulfuro (III) - compuestos de hidrógeno
Bismuto hidrógeno (bismuthan) - Haluros y nitratos
Fluoruros: fluoruro de bismuto (III), fluoruro de bismuto (V), fluoruro de óxido de bismuto
Cloruros: subcloruro de bismuto, cloruro de bismuto (III), óxido de cloruro de bismuto
Bromuros: subbromuro de bismuto, bromuro de bismuto (III), bromuro de óxido de bismuto
Yoduros: yoduro de bismuto (I), yoduro de bismuto (III), yoduro de óxido de bismuto
Nitratos: nitrato de óxido de bismuto (subnitrato de bismuto) - Como un anión
bismutato de sodio (V)
Precios, gráficos, historial de precios
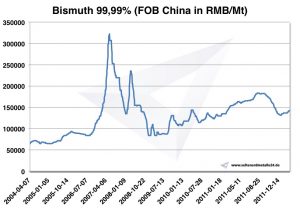
Gráfico Bismuto 2004 2011



