Cadmio, cd, número atómico 48
Precio de cadmio, historia, ocurrencia, extracción y uso
El cadmio (también raramente cadmio, griego καδμία kadmía, latín cadmea, 'tierra de zinc que contiene óxido o carbonato') es un elemento químico con el símbolo del elemento Cd y el número atómico 48. Por lo general, se cuenta entre los metales de transición, aunque tiene una cubierta d cerrada y, por lo tanto, es más similar a los elementos del grupo principal, especialmente los metales alcalinotérreos. En la tabla periódica está en el 5. Período, así como el 2. Subgrupo (grupo 12) o grupo de zinc.
Historia
1817 descubrió independientemente cadmio en carbonato de zinc contaminado por Friedrich Stromeyer y Carl Samuel Hermann. Stromeyer notó que el carbonato de zinc contaminado se decoloraba al calentarse, un comportamiento que no mostraba carbonato de zinc puro. Durante casi 100 años, el metal solo se ganó en Alemania.
Plinio el Viejo informó en su historia natural 77 alrededor del año Naturalis historia de Galmeifunden en Alemania: "cadmea [...] ferunt nuper etiam en Germania provincia repertum" (alemán: "recientemente se encontró en la provincia de Germania Galmei"). El término cadmio ya se usaba en la Edad Media, probablemente para el zinc o su mineral de carbonato. Como lo demuestra un documento emitido por el emperador Federico II en abril 1226 en Rávena, esto otorga el derecho al monasterio benedictino de San Pablo en Lavanttal "ut Cadmiae tam argentj quam plumbi et ferri, que en territorio ipsius monasteri de cetero inveniri contigerint "ad opus suum" (en alemán: "que el zinc, así como la plata, así como el plomo y el hierro, que se encuentran en la zona del monasterio, se utilizan para este fin").
A pesar de la toxicidad del cadmio y sus compuestos, se ha demostrado que el Codex Farmacéutico Británico de 1907 utiliza yoduro de cadmio como tratamiento para los exfoliantes (glándulas escrofulosas) y sabañones (glándulas escrofulosas).
1907 definió el Ångström como el 1 / 6438,4696 multiplicado por la longitud de onda de una línea espectral roja de cadmio en aire seco con un contenido de dióxido de carbono de 0,03% a una temperatura de 15 ° C y una presión de 1 atm. La Conferencia General 1960 sobre Pesos y Medidas aceptó la longitud de onda 1.553.164,13-doble de una línea roja espectral de cadmio como la definición secundaria de un medidor.
1942 utilizó láminas de cadmio Enrico Fermi en el primer reactor nuclear del mundo. Las láminas podrían ser empujadas dentro y fuera del reactor para controlar la reacción en cadena. El cadmio puede capturar neutrones gap moderados y, por lo tanto, influir en la criticidad del reactor.
Ocurrencia
El cadmio es un elemento muy raro. Su participación en la corteza terrestre es de solo 3 · 10-5 . El cadmio es extremadamente raro en su forma natural, es decir, en su forma elemental. Hasta ahora solo se conocen cinco sitios en tres países: el río Khann'ya en la cuenca de Vilyui, la cuenca del río Jana cerca de Verkhoyansk y la intrusión de Billeekh en la República Rusa de Sakha (Yakutia, Siberia Oriental); los pozos Goldstrike cerca de Lynn en el condado de Eureka, Nevada, y el macizo Burabaiskii en el área de Aqumola en Kazajstán.
Como minerales que contienen cadmio son principalmente la pantalla de cadmio Greenockit (CdS) con hasta 77,81% Cd y el Cadmiumspat Otavit (CdCO3) con hasta 65,20% Cd conocido, pero que son demasiado raros para la degradación comercial. Ambos están casi siempre asociados con varios minerales de zinc como la esfalerita (ZnS) y la smithsonita (ZnCO3).
En conjunto, hasta ahora (soporte 2018) se conoce algo más que minerales de cadmio 20. La muy rara Monteponita de óxido de cadmio tiene el mayor contenido de Cd hasta 87,54%. Otros minerales incluyen Hawleyit (77,81% Cd), Cadmoselita (58,74% Cd) y Drobecit (IMA 2002-034, 40,07% Cd).
Cadmio como mineral
El cadmio natural en su forma elemental fue descrito por primera vez por 1979 BV Oleinikov, AV Okrugin y NV Leskova. y reconocido por la Asociación Internacional de Mineralogía (IMA) como una especie mineral independiente (Número de Acceso Interno IMA: 1980-086a).
Según la clasificación de los minerales según Strunz (edición 9), el cadmio está bajo el sistema no. 1.AB.05 (Elementos - Metales e Intermetálicos - Familia Zinc-Latón - Grupo Zinc). En el anticuado 8. Sin embargo, el cadmio aún no figura en la edición de Strunz's Mineral Systematics. Solo en el último "Directorio de minerales Lapis" actualizado por 2018, que se basa en esta forma de numeración del sistema por consideración para coleccionistas privados y colecciones institucionales, el mineral recibió el sistema y el mineral no. E / A.4-40. La clasificación de minerales según Dana, que se usa predominantemente en países de habla inglesa, lidera el elemento mineral bajo el sistema no. 01.01.05.02.
Extracción y presentación.
El cadmio se obtiene exclusivamente como un subproducto de la fundición de zinc y, en menor medida, de la fundición de plomo y cobre. Cantidades más pequeñas también se aplican al reciclaje de hierro y acero.
La producción de cadmio depende de cómo se extrae el zinc. En la extracción de zinc seco, el cadmio se reduce primero con el zinc. Debido a que el cadmio tiene un punto de ebullición más bajo que el zinc, se evapora más fácilmente. Como resultado, una mezcla de cadmio y zinc se evapora del recipiente de reducción y reacciona en otras partes con oxígeno a cadmio y óxido de zinc. Posteriormente, esta mezcla se mezcla en un recipiente de destilación con coque y se destila del cadmio del zinc. La destilación fraccionada permite alcanzar niveles más altos de cadmio.
Durante la extracción húmeda de zinc, los iones de cadmio disueltos se reducen y precipitan con polvo de zinc. El cadmio resultante se oxida con oxígeno a óxido de cadmio y se disuelve en ácido sulfúrico. De la solución resultante de sulfato de cadmio se obtiene por electrólisis con ánodos de aluminio y cátodos de plomo, especialmente electrolito cadmio puro.
Propiedades fisicas
El cadmio es un metal plateado brillante con una densidad de 8,65 g / cm3. Es suave (dureza de Mohs 2), plásticamente deformable y también se puede cortar con un cuchillo para dibujar alambres y martillar en hojuelas.
El cadmio se solidifica exclusivamente en el sistema de cristal hexagonal en el grupo espacial P63 / mmc (número de grupo espacial 194). Los parámetros de red del cadmio puro son a = 0,2979 nm (corresponde a 2,98 Å) y c = 0,5617 nm (corresponde a 5,62 Å) para unidades de fórmula 2 por celda unidad.
Similar al estaño, los ruidos típicos ocurren cuando se dobla el cadmio de pureza media (llamado estaño peltre en estaño). El cadmio pulido pierde su brillo en el aire después de unos días, incluso si es más resistente a la corrosión que el zinc. En el aire carbonatado, forma un recubrimiento blanco grisáceo que contiene dióxido de carbono. Fuertemente calentado, arde con una llama rojiza a amarilla a óxido de cadmio parduzco y dióxido de cadmio.
CdO fue probado por su alta toxicidad durante la Segunda Guerra Mundial por los Estados Unidos por su idoneidad como agente de guerra química.
Propiedades quimicas
En compuestos químicos suele ser divalente. Es químicamente similar al zinc, pero tiende a formar compuestos complejos con el número de coordinación 4. En el aire, el cadmio forma un oscurecimiento de la superficie debido a la oxidación. En medio alcalino, la superficie es insoluble, pesada en ácido sulfúrico y ácido clorhídrico, y fácilmente soluble en ácido nítrico.
Utilizar
Debido a la alta toxicidad del cadmio, su importancia disminuye. Desde diciembre 2011 está prohibido en joyería, aleaciones para soldar y en PVC en la Unión Europea. El cadmio es o ha sido utilizado:
- como protección contra la corrosión para materiales ferrosos (revestimiento de cadmio)
- como revestimiento de superficie para materiales de aluminio en ingeniería militar (p. ej. lanzacohetes)
- para baterías de níquel-cadmio
- para pigmentos de color amarillo a rojo intenso de sulfuro de cadmio y seleniuro de cadmio para pinturas y plásticos (mientras que su importancia práctica es baja debido a posibles riesgos para la salud, especialmente al quemar los artículos correspondientes)
- como aleación de metal en aleaciones de baja fusión, por ejemplo, materiales de soporte o metal de Wood
- antes de lubricante en frenos de disco
- como componente de materiales de soldadura (soldadura), también para aleaciones de soldadura fuerte
- para la producción de semiconductores
- Óxido de cadmio como fósforo en tubos de televisión en blanco y negro y adición en fósforo azul y verde de tubos de color
- Óxido de cadmio como una mezcla de plata en contactos de conmutación
- como material de protección contra neutrones térmicos y para barras de control en tecnología nuclear debido a la sección transversal particularmente alta del isótopo 113 para la captura de neutrones
- como fuente de radiación gamma de alta energía (alrededor de 7 MeV) de neutrones térmicos para la generación posterior de positrones por generación de pares
- Sulfuro de cadmio en medidores de exposición cuya sensibilidad espectral es similar a la del ojo humano
- Telururo de cadmio como sensor sensible al infrarrojo para cámaras (matrices de planos focales)
- en células solares de película delgada como telururo de cadmio o sulfuro de cadmio para la generación de energía
- Estearato de CD como estabilizador en plásticos, por ejemplo en PVC (insensible a la luz, pero mientras tanto de baja importancia práctica debido a posibles riesgos para la salud)
- anteriormente en los elementos normales de Weston para determinar la unidad de medida de voltaje, voltios 1
- Aleaciones de cadmio y bismuto para fusibles
- Aleaciones de plata y cadmio como desoxidantes en la producción de plata esterlina
- para joyería: aleaciones oro-verde oro-cadmio
- lámpara de cadmio
- láseres de helio-cadmio
- Iones de cadmio para bloquear canales de calcio activados por voltaje en electrofisiología
para colorear vidrio en amarillo, naranja y rojo mediante la adición de sulfuro de cadmio, seleniuro y teluro o mezclas de los mismos.
Los calcogenuros de cadmio sulfuro de cadmio (amarillo), seleniuro de cadmio (rojo) y telururo de cadmio (negro) son importantes semiconductores II-VI. Se producen, por ejemplo, en nanopartículas como puntos cuánticos (puntos cuánticos) y se utilizan, entre otras cosas, en bioquímica in vitro.
prueba
Como muestra preliminar de cadmio, la llamada sonda Glühröhrchen puede servir. Para este propósito, alguna sustancia madre se calienta en un Glühröhrchen de alto punto de fusión y se reduce la mezcla resultante de óxido de sulfuro con oxalato de sodio a los metales. Como componente volátil, el cadmio se evapora y se deposita como un espejo metálico en la parte superior del tubo.
Mediante la posterior adición de azufre y un recocido renovado, se forma sulfuro de cadmio a partir del espejo metálico y el vapor de azufre, que es rojo en el calor y amarillo a temperatura ambiente. Este cambio de color se puede repetir varias veces.
La reacción de detección de cationes de cadmio es la precipitación con solución de sulfuro o sulfuro de hidrógeno-agua como sulfuro de cadmio amarillo. Otros iones de metales pesados interfieren con esta detección, de modo que antes de realizar una separación catiónica.
Para la determinación cuantitativa de trazas de cadmio se recomienda la polarografía. Los iones de cadmio (II) entran en un nivel en 1 M KCl a -0,64 V (vs. SCE). En el rango ultra-traza, la voltamperometría inversa puede usarse en electrodos de mercurio. Muy sensible también es el tubo de grafito AAS de cadmio. Aquí, 0,003 μg / l todavía se puede detectar. El elemento relativamente volátil no tolera una temperatura de pirólisis alta. Un modificador de matriz como el nitrato de paladio y magnesio puede ayudar.
seguridad
El cadmio es muy tóxico y sus compuestos se clasifican como nocivos (como telururo de cadmio), tóxicos (por ejemplo, sulfuro de cadmio) o muy tóxicos (óxido de cadmio); También existe una sospecha razonable de un efecto cancerígeno en humanos. El polvo ingerido que contiene cadmio causa daños en los pulmones, el hígado y los riñones.
En áreas de trabajo donde se usan compuestos de cadmio calentados (estaciones de soldadura y baños de cadmio), asegúrese de una buena ventilación o extracción. De acuerdo con la Ordenanza de interdicción química, el contenido de cadmio en los plásticos no debe exceder 0,01 por ciento en peso (100 mg / kg). Este límite se aplica en toda la Unión Europea.
Desde diciembre, 2011 aplica una prohibición más estricta sobre el cadmio en plásticos, pinturas, estabilizadores y cierto procesamiento de metales en virtud del Reglamento REACH, entrada 23 en el anexo XVII. Anteriormente, la soldadura fuerte de plata generalmente contenía 10% a 25% cadmio, joyas para niños hasta 30%, PVC 0,2%. Con el 10. En diciembre 2011, se extendió la prohibición de soldaduras que contienen cadmio en la soldadura y la producción y comercialización de joyas chapadas con cadmio. Además, también se incluyeron todos los productos que contienen PVC, con la excepción del reciclaje de PVC. Con el Reglamento (UE) 2016 / 217 de 16. En febrero 2016, se agregó cadmio en ciertas pinturas y barnices a la entrada 23 en el Anexo XVII del Reglamento REACH. Además, el contenido de cadmio en ciertas pinturas y barnices que contienen zinc o productos que lo contienen ha sido limitado. Hay excepciones, por ejemplo, debido a la alta densidad de potencia de las baterías de Ni-Cd en aparatos eléctricos inalámbricos.
toxicología
El cadmio es un subproducto inevitable de la extracción de zinc, plomo y cobre en la industria química. El cadmio también se puede encontrar en fertilizantes y pesticidas.
Grabación y peligros
La Organización Mundial de la Salud ha rebajado repetidamente su declaración sobre la ingesta tolerable de cadmio en los últimos años, más recientemente 2013 a una ingesta mensual tolerable (TMI) de 25 μg por kilogramo de peso corporal. La Autoridad Europea de Seguridad Alimentaria ha emitido 2009 con un nivel significativamente menor de 2,5 μg por kilogramo de ingesta semanal tolerable de peso corporal (TWI).
El cadmio es absorbido por los humanos principalmente a través de los alimentos. Los alimentos ricos en cadmio incluyen: hígado, champiñones, mariscos y otros mariscos, cacao en polvo y algas secas. Además, la linaza contiene mucho cadmio, por lo que se recomienda no tomar más de 20 g de linaza al día. Además, desde la introducción de fertilizantes artificiales, ha habido una acumulación de cadmio en las tierras agrícolas y, por lo tanto, en casi todos los alimentos. Los recursos de fosfatos son limitados, y la mayoría de los recursos están contaminados con cadmio o metales pesados radiactivos. El contenido de cadmio de los depósitos de fosfato es muy diferente. Muchos países industrializados ya han introducido un límite al cadmio en los fertilizantes. En Austria, la concentración de cadmio se limita a 75 mg / kg P2O5. Además, el humo del tabaco transporta cantidades relativamente grandes de cadmio a los pulmones, desde donde se propaga con la sangre en el cuerpo.
Especialmente las personas que trabajan en fábricas con alto contenido de cadmio tienen un mayor riesgo. Pero también hay peligros de vertederos salvajes y trabajos en metal. La inhalación de cadmio puede dañar gravemente los pulmones e incluso provocar la muerte. Los accidentes en la industria, como en la provincia china de Guangdong, y décadas de emisiones, como en el caso de la enfermedad de Itai Itai (en humanos) y la enfermedad de Gressenicher (en el pastoreo de ganado), aclaran los peligros reales.
Daño en humanos
El cadmio puede acumularse gradualmente en el cuerpo debido a razones industriales o ambientales y causar una intoxicación crónica que es difícil de reconocer.
El cadmio se absorbe de la dieta a aproximadamente 5% en el intestino. Con la deficiencia de hierro y calcio, la tasa de absorción aumenta, lo que sugiere que los tres metales usan la misma vía de transporte. El cadmio estimula primero en el hígado la síntesis de metalotioneínas, con lo cual forma un complejo y se transporta a través del torrente sanguíneo a los glomérulos renales, donde se filtra y se extrae de los túbulos renales. En las células del túbulo, el complejo metalotioneína-cadmio se metaboliza y se libera Cd. Aquí nuevamente, el cd activa una mayor síntesis de metaltiona, que une aún más cadmio. La acumulación en los riñones causa daño a este órgano, lo que resulta en proteinuria. Debido a que el cadmio que se une a las proteínas se excreta muy lentamente, la vida media del cuerpo permanece hasta 30 años. Por lo tanto, el contenido de cadmio aumenta desde el nacimiento y cae nuevamente a una edad de 50-60 años.
El cadmio también daña los huesos, ya que finalmente conduce a la movilización de calcio. Cd compite en el intestino con el calcio por los sitios de unión en la proteína de unión a Ca en la mucosa intestinal. Además, Cd bloquea la resíntesis de 1,25-dihydroxycholecalciferol (calcitriol) en las células del túbulo renal. 1,25-Dihydroxycholecalciferol es necesario para activar la síntesis de la proteína de unión al calcio en la célula de la mucosa intestinal. En resumen, el cadmio causa una reabsorción reducida de calcio en el intestino y los riñones, así como una mayor excreción con orina con la consecuencia de una liberación de calcio de los huesos y, por lo tanto, la degradación de los mismos.
En el caso de intoxicación aguda por cadmio, la excreción biliar puede ser asistida por la administración de penicilamina o dimercaprol. Se desconoce un tratamiento eficaz y más allá de la intoxicación aguda por cadmio.
síntomas
- Diarrea, dolor de estómago y vómitos violentos.
- daño renal
- fracturas óseas
- Daño al sistema nervioso central.
- Daño al sistema inmune.
- Trastornos de la reproducción y posiblemente incluso infertilidad.
- Psychische Störungen
- Posible daño en el ADN y carcinogénesis.
- Pérdida del sentido del olfato
Conexiones
→ Categoría: compuesto de cadmio
Óxidos e hidróxidos
- Óxido de cadmio CdO
- Hidróxido de cadmio Cd (OH) 2
haluros
- Fluoruro de cadmio CdF2
- Cloruro de cadmio CdCl2
- Bromuro de cadmio CdBr2
- Yoduro de cadmio CdI2
calcogenuros
- Sulfuro de cadmio CdS
- CdSe de seleniuro de cadmio
- Telururo de cadmio CdTe
Otros compuestos
- Sulfato de cadmio CdSO4
- Nitrato de cadmio Cd (NO3) 2
- Cianuro de cadmio Cd (CN) 2
- Cd de estearato de cadmio (C17H35COO) 2
Precio del cadmio -> Precios estratégicos de los metales
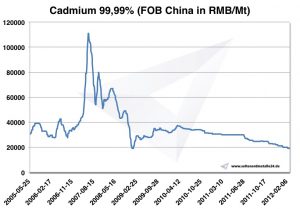
Gráfico de cadmio 2005-2012


