Magnesio, Mg, número atómico 12
Precio de magnesio, historia, ocurrencia, extracción y uso
El magnesio es un elemento químico con el símbolo del elemento Mg (Alquimia: ⚩) y el número atómico 12. En la tabla periódica de los elementos está en el segundo grupo principal o el 2. IUPAC grupo y por lo tanto pertenece a los metales alcalinotérreos.
El magnesio es uno de los diez elementos más comunes de la corteza terrestre. Ocurre en numerosos minerales, así como en la hoja verde de las plantas.
Historia
El origen de la designación del elemento se muestra de manera diferente en la literatura:
- del griego antiguo μαγνησία λίθος que significa "piedra magnética",
- Magnisia, un área en el este de Grecia,
- de Magnesia, una ciudad en Asia Menor en el territorio de la Turquía actual.
Sin embargo, todas las derivaciones dadas aquí parecen etimológicamente derivadas de los imanes o de sus Heros Magnes del mismo nombre.
Los compuestos de magnesio fueron conocidos y utilizados durante siglos antes de la producción de magnesio elemental. Magnesia alba designó carbonato de magnesio, mientras que magnesia era el nombre común de óxido de magnesio.
El físico y químico escocés Joseph Black fue el primero de los compuestos de magnesio en el 18. Siglo examinado sistemáticamente. 1755 en su trabajo De humore acido cibis orto y magnesia alba reconoció la diferencia entre la cal (carbonato de calcio) y la magnesia alba (carbonato de magnesio), que a menudo se confundían en ese momento. Tomó a Magnesia alba como el carbonato de un nuevo elemento. Debido a esto, a menudo se le llama al descubridor del magnesio, aunque nunca representó el magnesio elemental.
1808 ganó Sir Humphry Davy Hidruro de magnesio y magnesio humedecido por electrólisis con la ayuda de una columna de ceniza Volta, no en forma pura, sino como amalgama, ya que trabajó con un cátodo de mercurio. Entonces demostró que Magnesia es el óxido de un nuevo metal, al que llamó primero Magnium.
Al calentar cloruro de magnesio seco con potasio como agente reductor, 1828 logró producir pequeñas cantidades de magnesio puro para el químico francés Antoine Bussy. 1833 fue el primero en fabricar magnesio por electrólisis de cloruro de magnesio fundido. En base a estos experimentos, el químico alemán Robert Wilhelm Bunsen trabajó en los años 1840 y 1850 en procesos para la producción de magnesio por electrólisis de sales fundidas utilizando el elemento Bunsen que desarrolló. 1852 desarrolló una célula de electrólisis para producir grandes cantidades de magnesio a partir de cloruro de magnesio anhidro fundido. Este proceso todavía se prefiere hoy para la recuperación de magnesio.
La producción técnica de magnesio comenzó 1857 en Francia después de un procedimiento de Henri Etienne Sainte-Claire Deville y H. Caron. En el llamado proceso Deville-Caron, una mezcla de cloruro de magnesio anhidro y fluoruro de calcio se reduce con sodio. En Inglaterra, Johnson Matthey comenzó a fabricar 1860 utilizando un proceso similar. Sin embargo, debido a dificultades de fabricación, estas primeras empresas siguieron siendo poco rentables.
Ocurrencia
El magnesio no existe en la naturaleza debido a su reactividad en forma elemental. Como mineral, se presenta predominantemente en forma de carbonatos, silicatos, cloruros y sulfatos. En forma de dolomita, un mineral de magnesio incluso forma montañas, por ejemplo. B. en los Dolomitas.
Los minerales más importantes son dolomita CaMg (CO3) 2, magnesita (bitterspar) MgCO3, olivina (Mg, Fe) 2 [SiO4], enstatita MgSiO3 y kieserita MgSO4 · H2O.
Otros minerales son:
- Serpentina Mg3 [Si2O5] (OH) 4
- Talco Mg3 [Si4O10] (OH) 2
- Sepiolita Mg4 [Si6O15] (OH) 2
- Schönit K2Mg (NÚMERO DE SOX) 4 · 2 H6O
- Carnallita KMgCl3 · 6 H2O
- Espinela MgAl2O4
Cuando se disuelve en agua, causa dureza del agua junto con el calcio. En el agua de mar contiene más de 1 kg / m³.
Extracción y presentación.
La extracción de magnesio se produce principalmente de dos maneras:
- Por electrólisis de flujo de fusión de cloruro de magnesio fundido en células Downs: las células Downs consisten en grandes canales de hierro que se calientan desde abajo. Como ánodos sirven desde arriba las varillas de grafito incrustadas, que están rodeadas en las puntas de un cátodo anular. El magnesio metálico se acumula en la sal fundida y se elimina. El gas cloro resultante se acumula en la parte superior de la célula y se reutiliza para producir cloruro de magnesio a partir de óxido de magnesio. Para reducir el punto de fusión del cloruro de magnesio, se añaden cloruro de calcio y cloruro de sodio a la sal fundida.
- Por reducción térmica de óxido de magnesio (proceso Pidgeon): En un recipiente hecho de acero al cromo-níquel, se llena dolomita quemada, barita y un agente reductor como el ferrosilicio. Luego se evacua (se bombea fuera del gas) y se calienta a 1160 ° C. El vapor de magnesio se condensa en el tubo de la cabeza refrigerado por agua fuera del horno. El magnesio recuperado se purifica adicionalmente por destilación al vacío.
El proceso Pidgeon es hoy el proceso de fabricación más importante y se utiliza principalmente en China.
El 88% de la producción mundial de magnesio tiene lugar en China, donde 2015 produjo aproximadamente 800.000 t de magnesio metálico. A esto le sigue solo un pequeño porcentaje de cada cuota de mercado de Rusia, Israel y Kazajstán.
La producción de 1 kg de magnesio mediante el proceso Pidgeon produce gases de efecto invernadero con un equivalente de CO2 de aproximadamente 31 kg (en comparación: para 1 kg de acero, se forman equivalentes de CO0,5 entre 2 y 2 kg).
Aunque el magnesio está contenido en más de 60 minerales, solo la dolomita, la magnesita, la brucita, la carnallita, el talco y la olivina son de importancia comercial.
El catión Mg2 + es el segundo catión más abundante en agua de mar, lo que hace que el agua de mar y la sal marina sean fuentes comerciales de magnesio atractivas. Para extraerlo, se agrega hidróxido de calcio al agua de mar para formar un precipitado de hidróxido de magnesio.
El hidróxido de magnesio (brucita) es insoluble en agua y puede filtrarse y reaccionar con ácido clorhídrico para dar cloruro de magnesio concentrado.
La electrólisis produce cloruro de magnesio a partir de cloruro de magnesio.
Propiedades
La aleación de magnesio sólida, plateada y brillante es aproximadamente un tercio más ligera que el aluminio. El magnesio puro tiene una baja resistencia y dureza. Su módulo es sobre 45 GPa. En el aire, el magnesio está recubierto con una capa de óxido que, en contraste con el aluminio, no es completamente opaco. La razón de esto es que el óxido de magnesio tiene un volumen molar más bajo que el propio magnesio (MgO: 10,96 cm3 / mol, Mg: 13,96 cm3 / mol); s. relación Pilling-Bedworth.
Tiras finas o láminas se encienden fácilmente. Se quema en el aire con una llama blanca brillante a óxido de magnesio MgO y poco nitruro de magnesio Mg3N2. El polvo de magnesio recién hecho puede calentarse en el aire hasta que se enciende espontáneamente. Se esperan reacciones peligrosas a temperaturas más altas, especialmente con líquido fundido. También en muchos óxidos como el monóxido de carbono, el óxido de nitrógeno y el dióxido de azufre quema magnesio.
El magnesio reacciona con el agua para formar hidrógeno:
Reacción de magnesio con agua.
Esto forma una capa poco soluble de hidróxido de magnesio, que detiene en gran medida la reacción (pasivación). Incluso los ácidos débiles, como las sales de amonio, son suficientes para disolver la capa de hidróxido, ya que convierten los iones de hidróxido en agua y forman sales solubles. Sin pasivación, la reacción exotérmica procede violentamente; cuanto más fino es el polvo de magnesio, más violento. Con el aire, el hidrógeno liberado forma fácilmente una mezcla explosiva (gas oxihidrógeno).
El magnesio reacciona exotérmicamente con dióxido de carbono para formar óxido de magnesio y carbono:
Reacción de magnesio con dióxido de carbono.
Por lo tanto, el dióxido de carbono no extingue los incendios de magnesio, sino que los alimenta.
Es relativamente resistente al ácido fluorhídrico y a las bases, en contraste con el aluminio. La razón de esto es la baja solubilidad del fluoruro de magnesio (MgF2), que evita la formación adicional de iones Mg (OH) 3.
isótopo
Hay un total de isótopos 21 entre 19Mg y 40Mg de magnesio conocidos. De estos, tres, los isótopos 24Mg, 25Mg y 26Mg son estables y ocurren en la naturaleza. El isótopo con la mayor proporción de la composición isotópica natural es 24Mg con 78,99%, 25Mg tiene una participación de 10,0% y 26Mg de 11,01%. Los isótopos inestables más longevos son 28Mg, que se convierte en 20,915Al con una vida media de 28 horas bajo desintegración beta, y 27Mg, que también se desintegra a 9,435Al con una vida media de 27 minutos bajo desintegración beta. Todos los demás isótopos tienen una vida media corta de segundos o milisegundos.
Utilizar
Magnesio metálico
El polvo y el alambre de magnesio se utilizan en dispositivos incendiarios, bombas y municiones ligeras, anteriormente también como polvo flash. A menudo, las varillas de magnesio actúan como ánodos de sacrificio, protegiendo las partes de metales más nobles de la corrosión.
En la metalurgia, el magnesio encuentra un uso versátil,
- como agente reductor en el proceso de Kroll para la recuperación de titanio,
- como agente reductor para la recuperación de uranio, cobre, níquel, cromo y circonio,
- como constituyente de aleaciones de aluminio de los grupos AlSiMg y AlMg,
- como gránulos de magnesio para la desulfuración de hierro y acero,
- como agregado para fundición nodular,
- Como base de un grupo de aleaciones ligeras estandarizadas para la construcción de aeronaves y vehículos de motor (estas fundiciones requieren una capa de cubierta de cloruro de magnesio fundido para protección contra la entrada de aire y la oxidación, ver tratamiento de fusión),
- como combustible para antorchas que se queman bajo el agua.
En química orgánica, se utiliza para hacer compuestos de Grignard.
Debido a que el magnesio se enciende muy fácilmente, también se usa como un encendedor muy robusto. Estos bloques de magnesio, comercializados como Fire Starter Kits, tienen en un lado una varilla cuya abrasión se enciende espontáneamente en el aire, como el pedernal de un encendedor. El procedimiento es muy similar al método de la Edad de Piedra para quemar pedernal y yesca, con el magnesio desempeñando el papel de yesca. Primero, las astillas se raspan del bloque de magnesio con un cuchillo y se colocan sobre o debajo del combustible real. Luego, al raspar en la parte posterior "pedernal" (por ejemplo, con la parte posterior del cuchillo) se generan chispas lo más cerca posible de los giros de magnesio para encenderlos.
aleaciones de magnesio
La característica más importante de las aleaciones de magnesio, que las ha hecho más importantes que el aluminio y sus aleaciones, es la construcción liviana que permiten. Con una densidad de alrededor de 1,75 g / cm³, la diferencia con la construcción ligera de aluminio con una densidad de 2,75 g / cm³ es clara. Además, el rango de fusión entre 430 y 630 ° C, es decir, ahorro de energía menor. Sin embargo, las propiedades mecánicas como la resistencia a la tracción y la dureza son significativamente más bajas que con las aleaciones de aluminio. La baja densidad hizo que el magnesio fuera interesante para aplicaciones móviles desde el principio. La primera aplicación importante tuvo lugar antes de la Primera Guerra Mundial en la construcción del andamio para las rígidas aeronaves Zeppelin. En los automóviles, las aleaciones de magnesio se utilizaron para fabricar piezas de vivienda y llantas para todo tipo de aplicaciones móviles.1930 utilizó cada vez más aleaciones de magnesio en la construcción de aeronaves debido al ahorro de peso que permitió, lo que permitió vuelos más eficientes energéticamente y mayores cargas útiles. Todo esto condujo a una rápida expansión de la producción de magnesio en Alemania (Elektron de la fábrica química Griesheim) y después de 1940 también en los Estados Unidos. "Elektron" se convirtió en un nombre de marca registrada para las primeras aleaciones de magnesio inmediatamente después del inicio de la producción.
Otros usos para la fundición de magnesio se ofrecieron en el curso del desarrollo técnico, en parte relacionados con la guerra, en parte constructivos y al mismo tiempo optimizando las aleaciones. Como materiales a base de magnesio, se han desarrollado las aleaciones Mg-Al, Mg-Mn, Mg-Si, Mg-Zn y finalmente aleaciones de Mg-Al-Zn.
La caja de engranajes del VW Beetle se fundió en millones de capas de una aleación de Mg-Si. Hoy en día, las aleaciones de magnesio no solo se usan desde el punto de vista del ahorro de peso, sino que también se caracterizan por una alta atenuación. Esto conduce a una reducción de la vibración y la emisión de ruido cuando se somete a vibración. También por esta razón, las aleaciones de magnesio se han convertido en materiales interesantes en la construcción de motores, como en la industria automotriz. Entonces, no solo las partes del motor están hechas de aleación de magnesio, sino también cada vez más para la fundición de bloques de motor, el método híbrido / fundición híbrida aplicada, por primera vez en la producción en masa en el Alfa Romeo 156, más tarde también en BMW (ver también BMW N52).
En la fundición a presión (ver también debajo del moldeo) puede haber muchos componentes, incluso a gran escala, de paredes delgadas cerca de las dimensiones finales y producir sin costosas reelaboraciones. Como llantas, perfiles, carcasas, puertas, capotas, tapa del maletero, palanca de freno de mano y otros. No solo en la industria automotriz, sino también en ingeniería mecánica se construye con partes de aleaciones de Mg-Al-Zn.
Los esfuerzos para la construcción ligera ya condujeron al final del 20. Para aleaciones de magnesio-litio, incluso aleaciones de magnesio más livianas con la adición de litio.
Materiales de magnesio en medicina
Investigaciones recientes prometen un alto potencial de desarrollo de los materiales de magnesio como material de implante reabsorbible (por ejemplo, como un stent) para el cuerpo humano. Los materiales de magnesio deben protegerse contra la corrosión por contacto en la aplicación. Sin embargo, la resistencia a la corrosión contra las influencias atmosféricas normales es buena. El comportamiento de corrosión por contacto sería una ventaja decisiva cuando se usa como material de implante limitado temporal, ya que se disolvería de manera segura después de un cierto tiempo. Esto eliminó los riesgos y los costos de una cirugía de extracción de implantes.
Fertilizante
En el encalado de las zonas de cultivo y praderas, el magnesio en forma de óxido de magnesio o carbonato de magnesio se utiliza para compensar el agotamiento de magnesio del suelo por las plantas nuevamente. Además, se aumenta el pH del suelo y se mejora la disponibilidad de otros nutrientes. Aquí, el compuesto de magnesio generalmente se aplica junto con la cal como fertilizante complejo que contiene magnesio y calcio. Los que se producen naturalmente como fosfato de magnesio Bobierrit Mg3 (PO4) 2 (fosfato de trimagnesio) y nitrato de magnesio se utilizan como fertilizantes complejos.
Fisiología
El magnesio es una de las sustancias esenciales y, por lo tanto, es indispensable para todos los organismos. En la hoja verde de las plantas, la clorofila, el magnesio está contenida en aproximadamente 2%. Allí forma el átomo central de la clorofila. En la deficiencia de magnesio, las plantas hibernan y carecen de luz. Además, el magnesio del cuerpo humano debe suministrarse diariamente en cantidades suficientes para prevenir la deficiencia de magnesio.
El cuerpo de un adulto contiene aproximadamente 20 g de magnesio (en comparación: 1000 g de calcio). En el plasma sanguíneo, el magnesio se une al 40% de proteínas; el nivel sérico normal es 0,8-1,1 mmol / l. El magnesio está involucrado en algunas reacciones enzimáticas 300 como constituyente enzimático o coenzima. Además, los iones libres de Mg influyen en el potencial de las membranas celulares y actúan como segundos mensajeros en el sistema inmune. Estabilizan el potencial de reposo de las células nerviosas y musculares excitables y las células del sistema nervioso autónomo. La deficiencia de magnesio causa inquietud, nerviosismo, irritabilidad, falta de concentración, cansancio, sensación general de debilidad, dolor de cabeza, arritmia cardíaca y espasmos musculares. También puede llegar a un ataque al corazón. En el área del metabolismo y la psique, se cree que la deficiencia de magnesio exacerba la depresión y la psicosis esquizofrénica. Puede producirse un exceso de magnesio en la sangre como resultado de la ingesta excesiva y la disfunción renal y ocasiona trastornos en el sistema nervioso y el corazón.
La reabsorción de magnesio ocurre primero en el intestino delgado superior, pero también en el resto del tracto digestivo. Se excreta por los riñones y está presente en cantidades variables en todos los alimentos, así como en el agua potable. La dosis diaria requerida de aproximadamente 300 mg generalmente se logra a través de una dieta bien balanceada. Una mayor necesidad puede cubrirse con suplementos o medicamentos. Ligera deficiencia de magnesio es posible debido a una enfermedad grave, embarazo o deportes competitivos. Se producen deficiencias graves en la disfunción renal, diarrea prolongada, inflamación intestinal crónica, diabetes mellitus mal controlada, corticosteroides, ciertos diuréticos o alcoholismo con desnutrición.
Las sales de magnesio como citrato, gluconato, aspartato y clorhidrato de aspartato están aprobadas como medicamentos en Alemania, en dosis diarias de 100 a 400 mg contra estados de deficiencia y trastornos neuromusculares como espasmos musculares, migraña o complicaciones del embarazo. Los efectos secundarios incluyen molestias gastrointestinales y diarrea, con sobredosis también fatiga y disminución del pulso. Las contraindicaciones incluyen disfunción renal y ciertas arritmias cardíacas.
Para la ingesta oral de suplementos de magnesio (tabletas, tabletas masticables o pastillas, gránulos para disolución en líquido), por un lado, la dosis es importante. Varios estudios han concluido que cuando se toma 120 mg se absorbe aproximadamente 35%, pero cuando se toma una dosis diaria completa de 360 mg solo se absorbe aproximadamente 18%. Para la absorción en el cuerpo, la forma de los compuestos utilizados hoy en medicamentos es irrelevante, ya que son farmacológica y biológicamente y clínicamente equivalentes; Las sales orgánicas como el aspartato de magnesio o el citrato de magnesio solo son absorbidas más rápidamente por el cuerpo que los compuestos inorgánicos. Por otro lado, el magnesio adicional sigue siendo beneficioso en el cuerpo solo si hay suficientes moléculas de unión disponibles en el cuerpo; Esto se realiza mediante ajustes bioquímicos solo después de un aumento prolongado en el suministro o la ingesta de magnesio durante al menos cuatro semanas. El sulfato de magnesio ("sal de Epsom") se usaba anteriormente como laxante. Las sales de magnesio se usan en medicina alternativa.
Alimentos
El magnesio sirve como cofactor para diversas proteínas 300, especialmente las enzimas de unión a ATP y ácido nucleico. La ingesta diaria recomendada de magnesio en humanos, dependiendo de la edad y el sexo, está entre 24 y 400 mg por día.
El magnesio se usa como un compuesto en muchos alimentos, especialmente en productos integrales (por ejemplo, pan integral, pasta integral, arroz integral, avena, copos de maíz), agua mineral, especialmente agua medicinal, agua corriente de suficiente dureza, hígado, aves, pescado, semillas de calabaza, semillas de girasol, chocolate , Anacardos, cacahuetes, papas, espinacas, colinabo, bayas, naranjas, plátanos, sésamo, jarabe de remolacha azucarera, leche y productos lácteos.
Peligros y medidas de protección.
Los peligros del magnesio elemental dependen en gran medida de la temperatura y el tamaño de las partículas: el magnesio compacto es seguro a temperaturas inferiores al punto de fusión, mientras que los giros y los polvos de magnesio son altamente inflamables. Debido a la gran superficie, este último puede reaccionar fácilmente con el oxígeno en el aire. Con polvo de magnesio muy fino existe el peligro de combustión espontánea; Las mezclas de aire y polvo son incluso explosivas. La flematización es un tratamiento que reduce el riesgo en el procesamiento de magnesio, como los polvos metálicos en general. El magnesio fundido también se enciende espontáneamente en el aire. Incluso con muchas otras sustancias, como el agua y otros compuestos que contienen oxígeno, reacciona con magnesio de grano fino o calentado. Por lo tanto, las fundiciones de magnesio requieren protección permanente contra la entrada de oxígeno atmosférico. En la práctica, esto se hace cubriendo la masa fundida por medio de agentes ricos en cloruro de magnesio. El hexafluoruro de azufre también es adecuado como protección contra la oxidación. La cobertura anteriormente habitual con azufre elemental ya no se practica debido a la fuerte molestia causada por el dióxido de azufre.
En incendios de magnesio, se producen temperaturas de hasta aproximadamente 3000 ° C. Bajo ninguna circunstancia se pueden usar agentes extintores comunes como agua, dióxido de carbono, espuma o nitrógeno, ya que el magnesio reacciona violentamente con estos. Cuando el agua entra en un incendio de magnesio, existe un grave peligro de reacción de oxihidrógeno.
Para el fuego (fuegos metálicos) de una masa fundida, se aplica el principio de extinción de la asfixia, es decir, el desplazamiento rápido de oxígeno. En el caso más simple, cubriéndolo con arena seca, de lo contrario, aplicando una sal de cobertura para fundidos de magnesio. Polvo extintor de fuego clase D, polvo de magnesia (magnesia usta / magnesia quemada), si es necesario, también son adecuadas las virutas de ricino gris inoxidable seco.
Cuando se usa magnesio, por lo tanto, todas las instrucciones de seguridad deben seguirse exactamente. Bajo ninguna circunstancia se debe crear una atmósfera explosiva (polvo de magnesio, hidrógeno, aerosoles y vapores de lubricantes refrigerantes combustibles). También se deben observar las medidas normales de seguridad laboral, como la prevención de fuentes de ignición.
prueba
La mejor manera de detectar magnesio es con Magneson II, Titangelb o Chinalizarin.
Para la detección con Magneson II (4- (4-nitrofenilazo) -1-naftol), la sustancia madre se disuelve en agua y se hace alcalina. Posteriormente, se añaden unas gotas de una solución del colorante azoico Magneson II. En presencia de iones de magnesio, se forma un lago de color azul oscuro. Otros metales alcalinotérreos deben eliminarse previamente mediante precipitación como carbonatos.
Para la detección con Titangelb (Thiazolgelb G), la sustancia madre se disuelve en agua y se acidifica. Luego se mezcla con una gota de solución de Titangelb y se alcaliniza con una solución diluida de hidróxido de sodio. La presencia de magnesio produce un precipitado rojo brillante. Los iones de níquel, zinc, manganeso y cobalto interfieren con esta detección y primero deben precipitarse como sulfuros.
Para la detección con quinalizarina, la solución de muestra de ácido se mezcla con dos gotas de la solución de tinte. Luego se agrega una solución diluida de hidróxido de sodio hasta la reacción básica. Una mancha o precipitado azul indica magnesio.
Como reacción de detección de sales de magnesio y la formación de precipitados se puede utilizar con soluciones de sales de fosfato. La solución de muestra tamponada libre de metales pesados, con amoníaco y cloruro de amonio a pH 8 a 9 se le agrega con una solución disódica de hidrógeno fosfato. Una turbidez blanca soluble en ácido debido al fosfato de magnesio y amonio MgNH4PO4 indica iones de magnesio:
A partir de una solución amoniacal, Mg2 + también se puede detectar con oxina como un compuesto amarillo verdoso poco soluble. Esta prueba es adecuada para el proceso de separación de cationes.
Conexiones
En los compuestos, el magnesio se produce casi exclusivamente como un catión divalente con el estado de oxidación 2.
Óxidos e hidróxidos
El óxido de magnesio (magnesia) forma cristales incoloros en la estructura de cloruro de sodio. En la naturaleza, se presenta como un mineral volcánico periclas. Son de color blanco a gris, con inclusiones también verde oscuro, cristales regulares vidriosos brillantes. Se agrega a los alimentos como un regulador de acidez o agente de liberación y también tiene varias aplicaciones de ingeniería en laboratorios e industria. En medicina se usa para terapia de sustitución.
El hidróxido de magnesio es una sal incolora y fuertemente básica que se produce naturalmente como brucita mineral. Tiene una estructura de cristal trigonal en el grupo espacial P3m1 (grupo de habitaciones no. 164) y se usa como aditivo de aceite comestible (para fijar el dióxido de azufre), como floculante para el tratamiento de aguas residuales, como retardante de llama en termoplásticos (poliolefinas, cloruro de polivinilo) y elastómeros y como aditivo en agentes de limpieza utilizado. En medicina, se usa como un antiácido para la neutralización del ácido gástrico y como un laxante suave.
El peróxido de magnesio es un compuesto incoloro finamente en polvo que tiene una estructura de cristal de pirita en el grupo espacial Pa3 (número de grupo espacial 205). Se parece al peróxido de calcio y libera oxígeno por reacción controlada con soluciones acuosas. Tiene diversas aplicaciones en agricultura, farmacia y cosmética.
haluros
El cloruro de magnesio es altamente higroscópico y se encuentra en la naturaleza en el mineral bishopita (MgCl2 · 6 H2O), como carnallita doble sal (KMgCl3 · 6 H2O), en agua de mar y en lagos de sal. Se cristaliza en el sistema de cristal trigonal en el grupo espacial R3m (número de grupo espacial 166). En la tecnología alimentaria, se utiliza como regulador de la acidez, consolidador, potenciador del sabor, vehículo o agente de liberación. El hexahidrato de cloruro de magnesio, como batería térmica, puede almacenar y liberar energía térmica.
El fluoruro de magnesio forma cristales incoloros que cristalizan tetragonalmente en la estructura de rutilo en el grupo espacial P42 / mnm (número de grupo espacial 136). Sus propiedades ópticas y su estabilidad química lo convierten en un material importante para aplicaciones ópticas.
El bromuro de magnesio y el yoduro de magnesio también son sales higroscópicas que tienen una estructura cristalina trigonal en el grupo espacial P3m1 (número de grupo espacial 164).
Otros compuestos inorgánicos
El carbonato de magnesio ocurre en la naturaleza en grandes cantidades como magnesita (bitterspar). Cristaliza trigonal en el grupo espacial R3c (número de grupo espacial 167). En la industria alimentaria, se agrega como un regulador de acidez, portador o agente de liberación. Se usa para escalar y gimnasia y también se conoce como Magnesia y Chalk. Luego, los atletas se secan en las palmas de las manos antes de comenzar a practicar para que su piel no se pegue con demasiada fuerza al agarrar las barras de las barras o las barras de hierro de la barra horizontal o la barra. También tiene aplicaciones médicas e industriales.
El nitrato de magnesio es una sal incolora e higroscópica que es fácilmente soluble en agua. El hexahidrato (Mg (NO3) 2.6 H2O) tiene una estructura cristalina monoclínica con el grupo espacial P21 / c (número de grupo espacial 14). Se utiliza como fertilizante, almacenamiento de calor latente (como hexahidrato) o en la industria de la cerámica.
El sulfato de magnesio heptahidratado (Mg (SO4) · 7 H2O) se conoce como Epsomit mineral. Forma cristales incoloros que forman una red cristalina pseudotetragonal rómbica. Los cristales a menudo florecen en agregados fibrosos y forman estalactitas. Se utiliza para fertilizantes, como agente de secado y para aplicaciones médicas.
Los fosfatos de magnesio (dihidrógeno fosfato de magnesio (Mg (H2PO4) 2), hidrógeno fosfato de magnesio (MgHPO4) y fosfato de magnesio (Mg3 (PO4) 2)) se utilizan en la industria como materia prima de cerámica y como retardante de llama. En la industria alimentaria, se usan como aditivo para alimentos, laxante y aditivo alimentario. Los alimentos se agregan como un regulador de acidez o agente de liberación.
La espinela es un mineral frecuente de la clase mineral de óxidos e hidróxidos con la composición química idealizada MgAl2O4 y, por lo tanto, es químicamente un aluminato de magnesio. Cristaliza isotípicamente con magnetita en el sistema de cristal cúbico en el grupo espacial Fd3m (número de grupo espacial 227).
La dolomita es un mineral muy común de la clase mineral de carbonatos y nitratos con la composición química CaMg [CO3] 2 y, por lo tanto, es químicamente un carbonato de calcio y magnesio. Se cristaliza en el sistema de cristal trigonal en el grupo espacial R3 (número de grupo espacial 148).
El hidruro de magnesio se puede utilizar como almacenamiento de hidrógeno y energía. El hidrógeno liberado por el hidruro de magnesio puede producir una espuma metálica con propiedades interesantes que es más ligera que el agua.
Otros compuestos de magnesio cristalinos interesantes incluyen, por ejemplo, diboruro de magnesio, carburo de magnesio, nitruro de magnesio, sulfuro de magnesio, siliciuro de magnesio, germanuro de magnesio, metasilicato de magnesio, óxido de magnesio titanio y polonuro de magnesio.
organomagnesio
Los organilos de magnesio son compuestos organometálicos en los que existe un enlace entre el magnesio y el carbono. Entre los organomagnesio, los compuestos de Grignard (R-Mg-X) son, con mucho, los más importantes. Los organilos binarios de magnesio y los haluros de alquenilmagnesio juegan un papel significativamente subordinado.
Organylmagnesiumhalogenide
Los haluros de organilmagnesio (generalmente llamados compuestos de Grignard) se obtienen en un proceso directo mediante la reacción de los haluros de organil con giros de magnesio. Los compuestos de Grignard están en solución en el equilibrio de Schlenk. Reaccionan bajo sustitución de halógeno-organilo a organilos elementales:
General:
z. Por ejemplo:
o mediante la adición de organilos con múltiples sistemas de enlace:
General:
z. B.:
Los organilos binarios de magnesio (R2Mg, también llamados diorganilos de magnesio) se pueden producir de varias maneras:
por transmetalación, por ejemplo de mercurio diorganileno:
por dismutación en el cambio del equilibrio de Schlenk con la ayuda de 1,4-dioxano:
Los magnesaciclos (alcanos cíclicos con un magnesio en el anillo) también se pueden preparar con dioxano 1,4.
por metátesis de compuestos de Grignard con organilos de litio
por hidromagnesización (adición de MgH2 a 1-alquenos):
mediante la adición de magnesio elemental a enlaces dobles C = C en algunos hidrocarburos insaturados como 1,3-butadieno o antraceno (adición de metal). Por ejemplo, la reacción de 1,3-butadieno en tetrahidrofurano a temperatura ambiente es posible:

El butadieno de magnesio producido, también llamado (2-butene-1,4-diyl) magnesium, puede servir como fuente de aniones de butadieno en otras síntesis. De forma similar, se muestra el antraceno de magnesio amarillo anaranjado. El antraceno de magnesio se puede usar como catalizador para la hidrogenación de magnesio.
alkenylmagnesium
Los alquinos reaccionan con alquenos para dar haluros de alquenilmagnesio en el curso de la llamada carbomagnesación:

Otros compuestos organicos
El citrato de hidrógeno de magnesio y el dicitrato de trimagnesio son sales de magnesio de ácido cítrico. El citrato de magnesio se usa como medicamento.
El monoperoxiftalato de magnesio es un desinfectante para la desinfección de superficies.
El estearato de magnesio es la sal de magnesio del ácido esteárico y pertenece a los jabones de lima. Se compone de un ion de magnesio y dos iones de estearato de cadena larga.
Precio del magnesio
Precios del magnesio -> precios de metales estratégicos
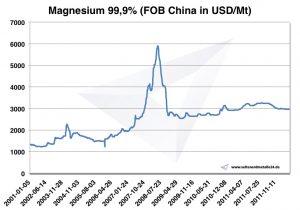
Cuadro Magnesio 2001-2011













