Silicio, Si, número atómico 14
Precio del silicio, ocurrencia, extracción y uso
El silicio, también silicio, es un elemento químico con el símbolo Si y el número atómico 14. Está en el 4. Grupo principal (grupo de carbono), o el 14. Grupo IUPAC y 3. Período de la tabla periódica de los elementos. En términos de fracción de masa (ppmw), es el segundo elemento más abundante en la cubierta de la tierra después del oxígeno.
El silicio es un semi-metal clásico, por lo tanto tiene propiedades de metales y no metales y es un semiconductor elemental. El silicio puro y elemental tiene un color gris-negro y tiene un brillo típicamente metálico, a menudo de bronce a azulado.
El silicio es extremadamente importante para la electrónica y dado que 2018 en forma de isótopo puro también sirve para la definición del kilogramo. El silicio elemental no es tóxico para el cuerpo humano, el silicio en forma de silicato unido es importante para los humanos. El cuerpo humano contiene aproximadamente 20 mg / kg de masa corporal de silicio; la cantidad disminuye con la edad.
Ortografía y etimología
Por defecto, se escribe el elemento 'silicio'. La notación con, c 'se usa principalmente en la jerga química. Ambas ortografías se originan del término latino silicia, sílice ', asociado con el silex latino' guijarro ',' roca '.
La palabra inglesa para silicio es silicio. Se incluye, por ejemplo, en el nombre de Silicon Valley. La traducción de silicona que se encuentra ocasionalmente es un falso amigo, porque las siliconas son una clase de compuestos químicos de silicio.
Historia
Uso en tiempos preindustriales
Los compuestos de silicio, especialmente las rocas, han desempeñado tradicionalmente un papel importante en la historia humana como material de construcción. Un ejemplo típico de una estructura de piedra temprana es Stonehenge. Otro material silíceo importante que se ha utilizado como material de construcción durante mucho tiempo es el suelo franco, que inicialmente se usó en la construcción de arcilla de fibra ramificada, más tarde en forma de ladrillo. El cemento, que también contiene silicato, fue desarrollado por primera vez por los romanos.
Debido a sus bordes afilados, las rocas silíceas también se usaron como herramientas en la Edad de Piedra. La obsidiana, por ejemplo, ya se extraía como un material de herramienta particularmente adecuado en el período protohistórico y ampliamente distribuido por el comercio. Feuerstein fue minado en áreas de tiza, como Bélgica y Dinamarca. En la extracción de metales, especialmente en la fabricación de acero, la escoria de silicato se usa para proteger las estufas y hornos del ingreso de oxígeno y como moldes de arcilla o arena; posiblemente se descubrió la fabricación de vidrio.
El descubrimiento como elemento
Por primera vez en el año, 1789 Antoine Lavoisier predijo que Silex es el óxido de un metal. En el año 1807, Humphry Davy postuló pruebas electroquímicas para la existencia de los metales silicio, aluminio, circonio y glucinio (berilio).
"Si hubiera sido tan afortunado de obtener este tema y de haber adquirido las sustancias metálicas que estaba buscando, debería haber propuesto los nombres de silicio, aluminio, circonio y glucium".
"Si hubiera estado tan feliz de tener evidencia más confiable sobre el tema y de haber enseñado las sustancias metálicas que buscaba, les habría sugerido los nombres de silicio, aluminio, circonio y glucium".
– Humphry Davy
En 1811, el químico Joseph Louis Gay-Lussac y Louis Jacques Thénard (véase Thénards Blau) produjeron silicio impuro y amorfo (a-Si, la forma alotrópica no cristalina del silicio). Para hacer esto, reaccionaron tetrafluoruro de silicio con potasio elemental. Un procedimiento similar fue seguido por Xnumx por Jöns Jakob Berzelius en Suecia haciendo reaccionar un hexafluorosilicato con potasio elemental. Berzelius limpió el silicio amorfo resultante mediante lavado. Fue el primero en reconocer la naturaleza elemental del silicio y le dio su nombre.
El término silicio se deriva de la palabra latina silex (guijarro, pedernal). Expresa que el silicio es más común en muchos minerales.
El término inglés silicio fue propuesto a 1817 por el químico escocés Thomas Thomson (1773-1852). La terminación -on está destinada a indicar la relación química con los no metales carbono (carbono) y boro (boro).
La primera producción de silicio puro y cristalino en el año 1854 sucedió al químico francés Henri Etienne Sainte-Claire Deville mediante electrólisis.
Ocurrencia
Toda la tierra es aproximadamente 15 por ciento en masa de silicio; en particular, el manto está compuesto en gran medida de fundidos de roca de silicato. La corteza terrestre es aproximadamente 25,8 por ciento en peso de silicio; Esto lo convierte en el segundo elemento químico más abundante después del oxígeno. Aquí, el silicio se produce esencialmente en forma de minerales de silicato o como sílice pura.
Entonces la arena se compone principalmente de sílice. El cuarzo es sílice pura. Muchas gemas están hechas de dióxido de silicio y más o menos mezclas de otras sustancias, como amatista, rosa y cuarzo ahumado, ágata, jaspe y ópalo. El silicio forma silicatos con muchos metales. Ejemplos de rocas silíceas son la mica, el asbesto, la arcilla, el esquisto, el feldespato y la arenisca. Los océanos también representan un gran depósito de silicio: en forma de ácido silícico monomérico, se disuelve en cantidades considerables en todos los océanos. En total (a partir de: 2011) se conocen minerales de silicio 1437, con la rara moissanita con un contenido de hasta 70% que tiene el mayor contenido de silicio (en comparación: el cuarzo mineral tiene un contenido de silicio de hasta 46,7%).
Dado que el silicio se produce en la naturaleza también en forma digna, es decir, en forma elemental, la Asociación Internacional de Mineralogía (IMA) lo reconoce como mineral y está en la clasificación de Minerales Strunz'schen (edición 9) bajo el sistema no. 1.CB.15 (edición 8: I / B.05-10) dirigido en el departamento de semimetales y no metales. En la clasificación de minerales más conocida en inglés de acuerdo con Dana, el elemento mineral lleva el sistema no. 01.03.07.01.
Se ha detectado silicio sólido (2011) en sitios 15, incluso por primera vez en el depósito de Nuevo Potosí en Cuba. Otras localidades se encuentran en la República Popular de China, Rusia, Turquía y Estados Unidos.
Silicatkreislauf
Los minerales silícicos se degradan permanentemente por reacción con el ácido carbónico del agua para formar ácido metasilícico y carbonatos, como se muestra en el ejemplo del silicato de calcio:
El ácido metasilícico insoluble reacciona además con el ácido carbónico para formar ácido ortosilícico soluble:
Sin embargo, el ácido ortosilícico reacciona consigo mismo nuevamente con relativa rapidez para formar dióxido de silicio (amorfo) y agua, siempre que el valor de pH sea ≥ 3. La concentración absoluta de ácido ortosilícico es relativamente baja (por ejemplo, <aprox. 7 mmol en agua de mar).
La incorporación de sílice o silicatos solubles en agua en organismos marinos (1.), Que se sedimentan tras la extinción después de ser ahogados, o por volcanismo y fuga de magma en el fondo marino retrocede los minerales de silicato (2.) Y el ciclo se cierra:
El horizonte temporal en el que tiene lugar este proceso es de varios millones de años, por lo que es considerablemente más largo que en el caso del ciclo del carbono de la naturaleza viva.
Silicio en la naturaleza viva
Además de la naturaleza esencial ya mencionada del silicio, hay una serie de organismos que producen estructuras que contienen dióxido de silicio. Las más conocidas son las diatomeas, esponjas (Porifera, Spongiaria) y radiolarios, que forman un exoesqueleto de dióxido de silicio por condensación catalizada por enzimas de ácido ortosilícico Si (OH) 4. Muchas plantas también contienen sílice en sus tallos y hojas. Ejemplos bien conocidos aquí son la cola de caballo y la planta de bambú. La columna vertebral de sílice acumulada les da estabilidad adicional.
Significado fisiológico para los humanos
El silicio parece ser necesario para la formación y maduración de los huesos. En terneros, la administración de ortosilicatos condujo a la proliferación de colágeno en la piel y el cartílago. La ingesta deseable derivada de experimentos con animales es 30 mg / d. Las deficiencias en humanos aún no se conocen.
Silica o Silica terra son productos orales. Esencialmente, contienen anhídridos de silicio (dióxido de silicio) y se dice que fortalecen la piel, las uñas, los huesos y el tejido conectivo y los mantienen saludables. Un efecto no ha sido científicamente probado.
Un exceso de silicio puede causar hemólisis de eritrocitos y, como consecuencia directa, cambios celulares.
Extraccion en el laboratorio
El silicio elemental se puede obtener a escala de laboratorio mediante reducción, a partir de sílice o tetrafluoruro de silicio, con metales básicos. Reacción 2.) Es un proceso aluminotérmico, que funciona solo con la adición de azufre elemental, la tercera ruta corresponde al descubrimiento del elemento:
El silicio amorfo altamente reactivo se puede obtener por reducción con sodio o acidólisis de siliciuros:
Extraccion en la industria
El silicio elemental se usa en diferentes grados de pureza en metalurgia (ferrosilicio), fotovoltaica (células solares) y en microelectrónica (semiconductores, chips de computadora). En consecuencia, es común en la industria clasificar el silicio elemental en función de diferentes grados de pureza. Se hace una distinción entre simg (grado metalúrgico, silicio bruto, 98-99% pureza), sisg (grado solar, silicio solar, impurezas menores que 0,01%) y victoria (grado electrónico, silicio semiconductor, impurezas de pequeños 10-9). Para las células solares, la pureza del material en todo su grosor es importante para garantizar la mayor vida útil posible del portador, para muchas aplicaciones en microelectrónica solo las capas superiores de aproximadamente 20 a 30 micras deben ser altamente puras.
Tradicionalmente, se utiliza el proceso de Siemens, en el que el silicio se hace reaccionar primero con cloruro de hidrógeno gaseoso a 300-350 ° C en un reactor de lecho fluidizado a triclorosilano (silicocloroformo).
Después de varios pasos de destilación, el triclorosilano se descompone térmicamente en presencia de hidrógeno en una inversión de la reacción anterior en barras de silicio hiperpuras calentadas a 1000-1200 ° C. El silicio elemental crece en las varillas. El cloruro de hidrógeno liberado se devuelve a la circulación. Como subproducto, el tetracloruro de silicio precipita, que se convierte en triclorosilano y se devuelve al proceso o se quema en la llama de oxígeno en sílice pirogénica. El proceso de Siemens produce 19 kg de residuos y subproductos por kg de silicio hiperpuro.
silicio en bruto
A escala industrial, el silicio elemental se obtiene reduciendo sílice con carbono en el horno de reducción de fundición a temperaturas de aproximadamente 2000ºC. El material de partida es arena de cuarzo o grava de cuarzo.
2002 produjo alrededor de 4,1 millones de toneladas de este silicio crudo industrial (Simg). Está suficientemente limpio para fines metalúrgicos y se utiliza como un componente de aleación y desoxidante para aceros (mejora de la resistencia a la corrosión, supresión de la cementita) y como materia prima para la producción de silano a través del proceso de Müller-Rochow, que en última instancia sirve principalmente para la producción de siliconas. Para la producción de ferrosilicio para la industria del acero (desoxidante en el proceso de alto horno), la reacción posterior se lleva a cabo convenientemente en presencia de hierro elemental.
Otras posibilidades de digestión de SiO2 son:
La digestión del refresco a aproximadamente 1600 ° C en el tanque de fusión:
La digestión hidrotérmica a aproximadamente 200 ° C con agua en un autoclave:
silicio solar
Para la producción de células solares, el silicio crudo debe purificarse aún más hasta convertirse en silicio solar (Sisg). Hay diferentes procedimientos para esto. Estos métodos son la parte más intensiva en energía en la producción de módulos solares debido a los muchos pasos intermedios complejos. Por lo tanto, varios métodos de fabricación como el método UMG (grado metalúrgico mejorado) y el método FBR (reactor de lecho fluidizado) ahora se están probando y utilizando.
Una alternativa libre de cloro es la descomposición del monosilano, que se descompone nuevamente después de un paso de limpieza en superficies calientes o al pasar a través de reactores de lecho fluidizado.
El silicio policristalino (polisilicio) obtenido de esta manera es adecuado para la producción de módulos solares y tiene una pureza superior al 99,99%. En la tecnología solar, como en la microelectrónica, se explotan las propiedades semiconductoras del silicio.
Solo de interés histórico es un procedimiento que fue utilizado previamente por la empresa DuPont. Se basó en la reducción de tetraclorosilano con vapor de zinc elemental a temperaturas de 950 ° C.
Sin embargo, debido a problemas técnicos y a la gran cantidad de residuos de cloruro de zinc, este proceso ya no se usa en la actualidad.
semiconductores de silicio
Silicio semiconductor monocristalino
Para aplicaciones en microelectrónica, se necesita silicio monocristalino de alta pureza (Sieg). En particular, las contaminaciones con elementos que también son adecuados como elementos de dopaje deben llevarse a concentraciones por debajo de ciertos valores críticos mediante extracción con crisol o fusión de zonas. El fabricante Shin-Etsu anuncia un "11N" -ref (= 99,999 999 999%) de sus lingotes.
En la extracción de crisol (proceso de Czochralski), el silicio solar obtenido en el proceso de Siemens se funde en crisoles de cuarzo. Se coloca un cristal de semilla de silicio monocristalino de alta pureza en esta masa fundida y se retira lentamente de la masa fundida mientras gira para cristalizar silicio de alta pureza en forma monocristalina en el cristal dejando casi todos los contaminantes en la masa fundida. El trasfondo físico de este proceso de purificación es la depresión del punto de fusión y la tendencia de las sustancias a cristalizar lo más puro posible.
Alternativamente, durante la zona de fusión con la ayuda de un calentador de inducción eléctrico (en forma de anillo), se pasa una zona fundida a través de una varilla de silicio, por lo que una gran parte de los contaminantes se disuelve en la masa fundida y migra con ella.
El silicio cristalino de alta pureza es actualmente el material base más adecuado para la microelectrónica; menos con respecto a sus propiedades eléctricas que por las propiedades químicas, físicas y técnicas del silicio y sus compuestos (dióxido de silicio, nitruro de silicio, etc.). Todos los chips comunes de computadora, memoria, transistores, etc. utilizan silicio de alta pureza como material de partida. Estas aplicaciones se basan en el hecho de que el silicio es un semiconductor. Mediante la incorporación selectiva de impurezas (dopaje), tales como indio, antimonio, arsénico, boro o fósforo, las propiedades eléctricas del silicio pueden variar dentro de un amplio rango. Sobre todo, por medio de los efectos de unión PN generados de este modo se pueden realizar una variedad de circuitos electrónicos. Debido a la creciente importancia de los circuitos electrónicos, también se habla de la era del silicio. El nombre de Silicon Valley para la región de alta tecnología en California también señala la enorme importancia del silicio en las industrias de semiconductores e informática.
El silicio amorfo se puede convertir en silicio policristalino utilizando láseres excimer. Esto es de creciente importancia para la fabricación de transistores de película delgada (TFT) para pantallas planas.
oblea de silicio
El silicio está disponible comercialmente tanto en polvo de grano fino como en piezas más grandes. El silicio de alta pureza para su uso en módulos solares o en componentes semiconductores generalmente se produce en forma de discos delgados de cristales individuales, las llamadas obleas de silicio (ver Fig.). Sin embargo, debido a la alta inversión inicial y los largos tiempos de construcción de los hornos necesarios, solo unas pocas empresas en todo el mundo producen silicio en bruto.
Los mayores productores de silicio metalúrgico son:
- Elkem (N, EE. UU.)
- Invensil (F, EE. UU.)
- Globe Metalúrgico (EE. UU.)
- Rima Metal (Br)
Hay sobre 15 otros grandes productores. Hay una serie de obras más pequeñas en la República Popular de China, por lo que es el mayor productor del país.
El mercado del polisilicio y el silicio hiperpuro ha estado en transición desde mediados de los 2000. Debido a la gran demanda de la industria solar, 2006 sufrió una escasez de silicio.
Propiedades fisicas
El silicio, como el germanio, el galio, el fósforo y el antimonio adyacentes a la tabla periódica, es un semiconductor elemental. La distancia energética entre la banda de valencia y la banda de conducción según el modelo de banda es 1,107 eV (a temperatura ambiente). Al doparse con elementos de dopaje adecuados, como boro o arsénico, la conductividad se puede aumentar en un factor 106. En el silicio dopado de esta manera, la línea de impurezas causada por impurezas y defectos de la red es significativamente mayor que la de la línea intrínseca, por lo que estos materiales se denominan semiconductores de impurezas. El parámetro de cuadrícula es 543 pm.
Espectro del índice de refracción complejo (N = n + ik) de silicio
El índice de refracción complejo, que depende de la longitud de onda de la luz, se muestra en la imagen adyacente. Aquí también se puede leer información sobre la estructura de la banda. El curso fuertemente creciente del coeficiente de extinción k muestra una transición de banda directa a 370 nm (E1 = 3,4 eV). Se puede observar otra transición de banda directa a ≈ 300 nm (EΓ2 = 4,2 eV). La transición de banda indirecta del silicio (Ej. = 1,1 eV) solo se puede adivinar. El hecho de que haya transiciones de banda indirectas adicionales puede verse en la curva ancha de k para longitudes de onda> 400 nm.
Al igual que el agua y algunas otras sustancias, el silicio tiene una anomalía de densidad: su densidad en forma líquida (a Tm = 1685 K) es mayor en 10-11% que en forma sólida y cristalina (c-Si) en 300 K.
Propiedades quimicas
En todo lo que ocurre en la naturaleza y en la gran mayoría de los compuestos producidos sintéticamente, el silicio forma exclusivamente enlaces simples. La estabilidad del enlace simple Si-O en contraste con el enlace doble de CO se debe a su carácter de doble enlace parcial, que resulta de la superposición de los pares solitarios de oxígeno con los orbitales d vacíos de silicio. La regla del doble enlace, que durante mucho tiempo se consideró válida, según la cual el silicio es un elemento de 3. Sin embargo, mientras tanto, se ha vuelto obsoleto ya que ahora se conoce una gran cantidad de compuestos producidos sintéticamente con dobles enlaces Si-Si. En 2004, el primer compuesto con un triple enlace formal Si-Si se caracterizó estructuralmente.
Con la excepción del ácido fluorhídrico que contiene ácido nítrico (en el que se forma el hexafluorosilicato), el silicio es insoluble en ácidos porque la pasivación ocurre a través de la formación de una capa de sílice sólida. Por otro lado, se disuelve fácilmente en álcalis cáusticos calientes con la formación de hidrógeno. A pesar de su potencial normal negativo (-0,81 V), es relativamente inerte en su forma compacta, ya que se cubre con una capa protectora de óxido en el aire.
Propiedades mecánicas
Las propiedades mecánicas del silicio son anisotrópicas (direccionales). Dependiendo de la orientación del cristal seleccionado, el módulo de elasticidad asume valores entre 130 GPa y 189 GPa. Se da una descripción general del comportamiento elástico en la notación de Voigt como para todos los cristales cúbicos a través de las tres constantes elásticas independientes C11, C12 y C44. La matriz de elasticidad es para silicio:
Las constantes elásticas tienen los siguientes valores:
Los módulos de elasticidad respectivos pueden calcularse a partir de las constantes elásticas para las direcciones individuales de cristal principal del silicio (100,110 y 111):
isótopo
Hay un total de isótopos 23 entre 22Si y 45Si de silicio conocidos. De estos, tres, los isótopos 28Si, 29Si y 30Si, son estables y naturales. El isótopo con la mayor participación de la composición isotópica natural es 28Si con 92,223%, 29Si tiene una participación de 4,685% y 30Si de 3,092%. Los isótopos inestables más longevos son 32Si, que entra en 153P (fósforo) con una vida media de 32 años bajo desintegración beta, y 31Si, que también se desintegra a 157,36P bajo desintegración beta con una vida media de 31 minutos. Todos los demás isótopos tienen una vida media corta de segundos o milisegundos.
28Si se forma en grandes estrellas hacia el final de su desarrollo en grandes cantidades (quema de oxígeno). Esta es la razón de la alta proporción de 28Si en el silicio total (92,23%) y también en la frecuencia de silicio en comparación con otros elementos. Desde 2009, se han hecho intentos para redefinir el kilogramo de unidad base SI como un conjunto dado de átomos 28Si; Estos intentos llevaron a 2018 a una nueva definición en noviembre. También son estables los isótopos 29Si (4,67% del silicio total) y 30Si (3,1%).
El isótopo radioactivo 31Si se descompone rápidamente (vida media 157,3 minutos) por radiación beta a fósforo estable. Esta circunstancia se puede utilizar para producir silicio n-dopado muy homogéneamente. Para este propósito, el silicio se irradia con neutrones, por captura de neutrones luego surge 31Si y, por lo tanto, 31P. Una fuente de neutrones adecuada para este método es la fuente de neutrones de investigación Heinz Maier-Leibnitz. Más duradero es 32Si con una vida media de 172 años. Las huellas de este isótopo se forman en la atmósfera de la tierra por espalación de argón por radiación cósmica. 32Si se descompone en el 32P igualmente radiactivo (días 14,3 de semivida) y luego en 32S (azufre) estable. Todos los demás isótopos se desintegran en unos pocos segundos.
Seguridad
El silicio es un polvo combustible como muchos elementos. Como polvo y gránulos es irritante. El silicio compacto es inofensivo.
El silicio poroso hidrogenado, es decir, cubierto de hidrógeno, puede ser altamente explosivo bajo la irradiación láser y un aumento de oxígeno, como descubrieron los investigadores de la Universidad Técnica de Munich por casualidad. La voladura en el rango de micrómetro es posible. La velocidad de detonación y la energía de detonación son más altas que para TNT y dinamita.
Uso en tecnología
1947 descubrió a John Bardeen, Walter Brattain y William Shockley la resistencia eléctrica controlable, el transistor, primero en un solo cristal de germanio. El silicio de conexión alegre podría aislarse solo más tarde en la pureza necesaria para fines electrónicos. 1958 Robert Noyce en Fairchild y Jack S. Kilby en Texas Instruments desarrollaron independientemente el circuito integrado (IC) en un chip de silicio. Desde aproximadamente 1970, el silicio es el material básico de la mayoría de los productos semiconductores y es el material base para muchos sensores y otros sistemas micromecánicos (por ejemplo, brazo de palanca en un microscopio de fuerza atómica). El silicio es también el componente elemental de la mayoría de las células solares.
En noviembre, 2005 informó sobre los primeros resultados prometedores con láseres de silicio.
El silicio se usa como combustible de alta energía en muchos explosivos.
Dado que el silicio se expande con la solidificación, mientras que la mayoría de las sustancias se contraen, se agrega a muchas aleaciones de fundición. Por ejemplo, el hierro fundido siempre contiene aproximadamente 2% Si. De particular importancia son las aleaciones de aluminio-silicio en las que el contenido de Si puede ser de hasta 20%. Esta es la variedad más importante de todos los materiales de aluminio fundido.
Conexiones
El silicio es casi siempre tetravalente en compuestos químicos. En consecuencia, el átomo de silicio en los compuestos suele ser de cuatro coordenadas. Además, ahora hay una serie de compuestos en los que el silicio tiene una coordinación de cinco o seis veces. Además del silicio tetravalente y los compuestos preparados sintéticamente de silicio divalente (sililenos) son conocidos, pero la mayoría son muy inestables. De mayor importancia es solo el monóxido de silicio, que se utiliza como material para la compensación de lentes ópticas. Además, 2012 también detectó experimentalmente un compuesto de tres coordenadas similar a la estructura unidimensional del grafeno, el llamado siliceno.
Toda la química del silicio se caracteriza esencialmente por la alta afinidad del silicio por el oxígeno. El silicio suele ser el compañero electropositivo de un compuesto químico, aunque también hay compuestos con silicio negado formalmente. Estos son en su mayoría siliciuros donde el silicio también puede formar aniones verdaderos.
![]()
Inversión de polaridad vinculante
Particularmente notable es la inversión de la polaridad de enlace de los enlaces elemento-hidrógeno en la transición de carbono a silicio. Aquí, la diferencia de electronegatividad cambia de + 0,45 (carbono-hidrógeno) a -0,2, razón por la cual los compuestos de silano tienen una reactividad completamente diferente a la de los hidrocarburos.
Los compuestos más importantes de silicio se pueden dividir en las siguientes clases, de las cuales se mencionan algunos representantes:
Conexiones binarias
- carburo de silicio
- sílice
- nitruro de silicio
- siliciuros
silicato
- Circón y todos los demás silicatos y compuestos de ácido silícico.
haluros de silicio
- tetrafluoruro de silicio
- El tetracloruro de silicio
- Triclorosilano (silicocloroformo)
hidruros de silicio
- monosilano
- Silane
Compuestos orgánicos de silicio
- Tetrametilsilano (TMS, estándar de RMN)
- Metilclorosilanos como el diclorometilsilano (componentes básicos para las siliconas)
- phenylchlorosilane
- carbosilanos
- Carbosilazane
- carbosiloxanos
Compuestos de silicio polimérico
- Las siliconas (siliconas, poliorganosiloxanos) se forman por polimerización y pertenecen a los plásticos industriales más importantes.
- Los compuestos poliméricos de silicio-oxígeno encuentran aplicación en muchas áreas; Sirven como lubricantes y selladores en la industria cosmética y de la construcción.
- Polisilanos, -carbosilanos, -carbosilazanos, -carbosiloxanos
Otros
Hasta el día de hoy, a menudo ocurre que la palabra inglesa "silicio" (para silicio) se traduce o pronuncia falsamente en artículos de divulgación científica o en doblaje de películas como "silicona" ("silicona"). Esto sucedió, por ejemplo, en la serie de ciencia ficción Star Trek, el thriller del agente de James Bond Frente a la muerte o en la serie animada Los Simpson. Ejemplo: "¿La forma de vida está hecha de carbono o silicona?"
Precios del silicio
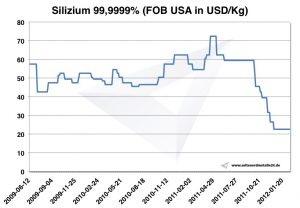
Gráfico de silicio 2009-2012





















