Tantalio, Ta, número atómico 73
Precio, aparición, extracción y uso del tantalio
El tantalio [ˈtantalum] es un elemento químico con el símbolo Ta y el número atómico 73; en la tabla periódica está en el quinto subgrupo o grupo de vanadio. Es un metal de transición brillante, dúctil, gris grafito y que se encuentra raramente. El tantalio se utiliza principalmente para condensadores con alta capacitancia y al mismo tiempo de pequeño tamaño. Dado que el metal no es tóxico e inerte para los fluidos corporales, también se utiliza para implantes, por ejemplo, como uñas para huesos.
El elemento fue descubierto en 1802 por Anders Gustav Ekeberg en un mineral de columbita finlandés. Se separó un óxido muy estable (óxido de tantalio (V)) que no se disolvió en ningún ácido. Lleva el nombre de Tantalus, una figura de la mitología griega. Según Ekeberg, la razón de este nombre es que el óxido muy permanente "tiene que languidecer y no puede saciar su sed, como Tantalus en el inframundo".
Casi al mismo tiempo, Charles Hatchett encontró algo muy similar en un mineral colombiano columbio. Se pensó que los dos elementos eran idénticos hasta 1844, cuando Heinrich Rose reconoció que dos elementos diferentes estaban presentes en los minerales de columbita, a saber, tantalio y columbio. Llamó a este último niobio.
Después del descubrimiento del nuevo elemento, varios químicos intentaron representar el tantalio en forma elemental. El primero en producir tantalio elemental mediante la reducción del fluoruro de tantalio con potasio fue Jöns Jakob Berzelius en 1815. Sin embargo, al igual que el tantalio representado por Rose, su metal era solo 50% de tantalio. En 1902, Henri Moissan intentó producir tantalio en un horno eléctrico, pero el carbono que contenía hizo que su producto fuera muy duro y quebradizo.
El primero que pudo producir tantalio puro y dúctil fue Werner von Bolton en 1903. Lo logró reduciendo los óxidos incandescentes en el vacío y fundiendo el metal de tantalio impuro en el vacío y utilizando un arco de llama eléctrica.
La primera aplicación del nuevo elemento fue como filamento en bombillas. El motivo del cambio del osmio utilizado anteriormente al tantalio fue que es más fácil de procesar y tiene una temperatura utilizable más alta posible de hasta 2300 ° C. Más tarde fue reemplazado por tungsteno, que tiene un punto de fusión aún más alto y, por lo tanto, permite un espectro de luz más cercano al de la luz solar y una salida de luz más alta.
En 1922 se encontró una nueva aplicación para el tantalio con su uso en rectificadores y un año después en tubos de radio.
Ocurrencia
El tantalio es un elemento raro en la tierra con un contenido de 2 ppm en la corteza continental y 8 ppm en la capa terrestre. La frecuencia es comparable a la del arsénico y el germanio. Dentro del grupo, la frecuencia disminuye en una potencia de diez. El tantalio no se produce de forma natural, sino solo en forma de sus compuestos en varios minerales. Debido a la similitud de los dos elementos, los minerales de tantalio siempre contienen niobio y viceversa (socialización). Los minerales más importantes son los de la serie columbita y tapiolita, en los que varios minerales de fórmula general (Mn, Fe2+) (Nb, Ta)2O6 ser resumido Las columbitas de tantalio también se llaman tantalita designada. Ejemplos de minerales que contienen tantalio en esta serie son la ferrotapiolita (Fe2+, Mn2+) (Ta, Nb)2O6 y tantalita de manganeso MnTa2O6. Estos minerales a menudo se denominan coltán. Los minerales menos comunes son la microlita o la toreaulita.
Los países productores más importantes de minerales de tantalio en 2007 fueron Australia con 850 toneladas y Brasil con 250 toneladas. El coltán también se encuentra en Canadá y en varios países africanos como Etiopía, Mozambique y Ruanda. Los acontecimientos en el este de la República Democrática del Congo, que fueron ferozmente controvertidos en la Guerra del Congo de 1996-2008, se dieron a conocer en los medios de comunicación.
Extracción y presentación.
Dado que el tántalo y el niobio siempre están presentes juntos en los minerales utilizados para la extracción de tántalo, deben separarse para recuperar los metales puros. Esto se complica por la gran similitud de los dos elementos.
El primer método de separación fue desarrollado por Jean Charles Galissard de Marignac en 1866. Usó la diferente solubilidad de los dos elementos en ácido fluorhídrico diluido. El tantalio forma el K ligeramente soluble2$ TaF7, Niobio el K bien soluble3NbOF5 · 2 H2O.
El proceso que se utiliza técnicamente en la actualidad se basa en la extracción y utiliza la diferente solubilidad de sales complejas de flúor en agua y determinados disolventes orgánicos. La mezcla de minerales se disuelve primero en ácido fluorhídrico concentrado o mezclas de ácido fluorhídrico y sulfúrico. Los fluoruros complejos [NbOF5]2- y [TaF7]2-. Después de la filtración de los componentes insolubles, la separación puede realizarse mediante extracción líquido-líquido con ayuda de metil isobutil cetona. Si se añade metil isobutil cetona a la solución, los complejos de niobio y tantalio pasan a la fase orgánica, mientras que otros elementos, como el hierro o el manganeso, permanecen en la fase acuosa. Cuando se agrega agua a la fase orgánica separada, solo el complejo de niobio se disuelve en ella, el tantalio permanece en la metil isobutil cetona.
Con la ayuda de fluoruro de potasio, el tantalio se puede convertir en un K poco soluble2[$ TaF7] ser derribado. La reducción a tantalio elemental generalmente se realiza con sodio.
![\ mathrm {K_2 [TaF_7] + 5 \ Na \ longrightarrow Ta + 5 \ NaF + 2 \ KF}](https://upload.wikimedia.org/wikipedia/de/math/4/0/8/4082df7e6f3cde8acd65ddf4230284e5.png)
Reducción con sodio
Una posible alternativa a la extracción es la destilación fraccionada. Los diferentes puntos de ebullición de los dos cloruros pentacloruro de niobio y pentacloruro de tantalio se utilizan para este propósito. Estos se pueden obtener a altas temperaturas a partir de los minerales con cloro y coque. Después de la separación, el cloruro de tantalio también se reduce al metal con sodio.
Además de los minerales de columbita-tantalita, la escoria de la fundición de estaño es una fuente importante para la extracción de tantalio (contiene un pequeño porcentaje de tantalio).
Propiedades fisicas

Estructura cristalina de tantalio,a = 330,3 pm
El tantalio es un metal pesado de alto punto de fusión, claramente gris púrpura, duro como el acero (dureza Vickers: 60–120 HV), similar al niobio en la mayoría de sus propiedades. Cristaliza en una estructura cristalina cúbica centrada en el cuerpo. Con un punto de fusión de alrededor de 3000 ° C, el tantalio tiene el punto de fusión más alto de todos los elementos después del tungsteno, el carbono y el renio. Si solo se almacena una pequeña cantidad de carbono o hidrógeno en el metal, el punto de fusión aumenta significativamente. Con un punto de fusión de 3880 ° C, el carburo de tantalio tiene uno de los puntos de fusión más altos de todas las sustancias.
El tantalio se convierte en un superconductor por debajo de una temperatura de transición de 4,3 Kelvin.
Si bien el tantalio puro es dúctil y se puede estirar considerablemente (resistencia a la tracción: 240 MPa), incluso pequeñas cantidades de carbono o hidrógeno que se le agregan cambian significativamente la resistencia mecánica. El material se vuelve quebradizo y difícil de procesar. Este efecto se utiliza para producir polvo de tantalio. En tecnología, se carga con hidrógeno y, por lo tanto, se fragiliza, luego se tritura en consecuencia y se hornea o se libera de hidrógeno nuevamente a una temperatura más alta.
Propiedades quimicas
El tantalio es un metal base y reacciona a altas temperaturas con la mayoría de los no metales, como el oxígeno, los halógenos o el carbono. Sin embargo, a temperatura ambiente, el metal está protegido por una fina capa de óxido de tantalio (V) y, por lo tanto, pasivado. La reacción solo tiene lugar a partir de una temperatura de unos 300 ° C.
En la mayoría de los ácidos, el tantalio no es soluble debido a la pasivación, incluso la agua regia no puede disolver el metal. El tantalio es atacado solo por ácido fluorhídrico, oleum (una mezcla de ácido sulfúrico y trióxido de azufre) y sales fundidas.
isótopo
Hay un total de 30 isótopos y 26 isómeros centrales de 155Ta up 185Ta lo sabe. El tantalio natural consiste casi exclusivamente (99,988%) en el isótopo 181Ta. 0,012% del isómero del núcleo también está presente 180mTa antes. Aunque en teoría esto puede ser radioactivo, hasta ahora no se ha observado desintegración. Por lo tanto, la vida media debe exceder 1 · 1015 Años
Utilizar
La mayor parte del tantalio (volumen de producción anual mundial de 1.400 t) se utiliza para condensadores muy pequeños con alta capacitancia. En 2007, el 60% del tantalio se utilizó en la fabricación de condensadores. Estos condensadores electrolíticos de tantalio se utilizan en todas partes en la microelectrónica moderna, por ejemplo, para teléfonos móviles y en la construcción de automóviles. El efecto se basa en la capa de óxido de tántalo en la superficie de la lámina de tántalo de la herida, que sigue siendo estable y aislante de forma fiable incluso en versiones muy delgadas. Cuanto más fina sea la capa entre los electrodos, mayor será la capacidad con la misma superficie de lámina; Además, el óxido de tantalio tiene una permitividad extremadamente alta, lo que también aumenta la capacidad.
Dado que el tantalio no es tóxico y no reacciona con tejidos o fluidos corporales, el tantalio elemental se utiliza para implantes e instrumentos médicos. Por ejemplo, los clavos de hueso, las prótesis, los brackets y los tornillos de la mandíbula están hechos de tantalio. Además, es un medio de contraste de rayos X poco utilizado debido a sus altos costos.
El tantalio se utiliza en la industria química debido a su durabilidad. Sirve como material de revestimiento para recipientes de reacción y se utiliza para intercambiadores de calor y bombas. Para estos fines, generalmente no se usa tantalio puro, sino aleaciones que contienen 2,5-10% de tungsteno. Estos son más estables y resistentes que el tantalio puro. Al mismo tiempo, se conserva la ductilidad deseada. Otros usos son equipos de laboratorio, hileras y cátodos de tubos de electrones. Aquí, el tantalio se beneficia del hecho de que puede absorber hasta 800 partes en volumen de gases a 740 ° C (efecto getter), lo que asegura un alto vacío en los tubos.
Las superaleaciones que se utilizan en la construcción de turbinas y motores de aviones contienen hasta un 9% de tantalio. Agregar 3–4% de tantalio a una superaleación de níquel aumenta la resistencia del material a altas temperaturas.
seguridad
Trabajar con tantalio y sus compuestos normalmente no causa ningún problema en condiciones de laboratorio. Los compuestos de tantalio y tantalio elementales no son tóxicos. Sin embargo, existen vagas indicaciones de que algunos compuestos de tantalio son cancerígenos. El polvo y el polvo de tantalio, al igual que otros metales finamente divididos, presentan un alto riesgo de incendio y explosión.
Conexiones
Tantalio (V) óxido Ta2O5 es un polvo blanco que se usa para fabricar gafas de alta refracción y materiales de cristal especiales.
El carburo de tantalio TaC, con su temperatura de fusión de 3880 ° C y una dureza casi la de un diamante, sirve como capa protectora en las aleaciones de alta temperatura en motores y herramientas de corte.
| General | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre, símbolo, número atómico | Tantalio, Ta, 73 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| serie | Los metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 5, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | gris | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS | 7440-25-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fracción de masa de la capa de tierra | 8 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| nuclear | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| masa atómica | 180,9479 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calculado) | 145 (200) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| configuración electrónica | [Xe] 4f14 5d3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionización | 761 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionización | 1500 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| físicamente | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| estado físico | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| estructura cristalina | centrado en el cuerpo cúbico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| densidad | 16,65 g / cm3 (20 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| dureza de Mohs | 6,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismo | paramagnético = 1,8 10-4) = 1,8 10-4) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto de fusión | 3290 K (3017 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto de ebullición | 5731 K (5458 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen molar | 10,85 · 10-6 m3/ mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 735 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| calor de fusión | 36 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| velocidad del sonido | 3400 m / s en 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica específica | 140 J / (kg · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad electrica | 7,61 · 106 A / (V · m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| conductividad térmica | 57 W / (m K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Químico | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| estados de oxidación | 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| potencial normales | −0,81 V (½ Ta2O5 + 5 H.+ + 5 e- → Ta + 2½ H2O) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| electronegatividad | 1,5 (escala Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| isótopo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| propiedades de RMN | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| seguridad | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Precios de tantalio
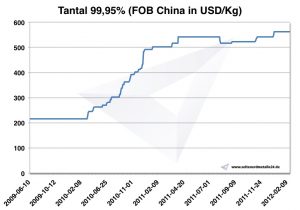
Gráfico Tantalio 2009-2012
Precios actuales de tantalio


