Telurio, Te, número atómico 52
Precio de telurio, ocurrencia, extracción y uso
El telurio [tʰɛluːɐ̯] (latín tellus "tierra") es un elemento químico raro con el símbolo del elemento Te y el número atómico 52. En la tabla periódica está en el sexto grupo principal, o 16. Grupo IUPAC y 5. Periodo y es uno de los Chalkogens. Su frecuencia es similar a la del oro, con el que también entra en varios compuestos que se encuentran en la naturaleza como minerales. El telurio cristalino es un semimetal metálico blanco plateado y brillante que se parece al estaño y al antimonio en apariencia. Reacciona quebradizo ante el estrés mecánico y, por lo tanto, puede pulverizarse fácilmente. En compuestos químicos con no metales tiene un comportamiento cercano al azufre y selenio, en aleaciones y compuestos intermetálicos, sin embargo, muestra propiedades (semi) metálicas muy pronunciadas.
Historia
El telurio fue 1782 por el químico y mineralogista austríaco Franz Joseph Mueller von Reichenstein (1740-1825) en investigaciones de minerales de oro de la mina Mariahilf en el monte Faczebaja en Zlatna (alemán Klein Schlatten, Zalatna) cerca de Sibiu (alemán Hermannstadt , Transilvania, Rumania), que produjo menos oro de lo esperado. Se había dado cuenta de los minerales por el tratado científico de Ignaz von Born (1742-1791) sobre el Spiesglaskönig moteado en Transilvania. Spiesglaskönig se refiere al antimonio sólido, el vidrio Spies es un nombre antiguo para el mineral Antimonit (Stibnit, Grauss casting Sb2S3). Von Born mantuvo el metal sólido en el mineral de oro como antimonio y atribuyó el bajo rendimiento a una combinación de oro con antimonio. Mueller von Reichenstein contradijo este punto de vista y lo sostuvo primero por "bismuto sulfurado". Después de más investigaciones, cuyos resultados publicó entre 1783 y 1785 en un ensayo de cuatro partes, pero también excluyó el bismuto, ya que el metal, en contraste con el antimonio y el bismuto, prácticamente no reaccionó con el ácido sulfúrico. Le dio a la fase metálica el nombre de metallum problematicum (también aurum problematicum o aurum paradoxum). Según el conocimiento actual, hay junto al teluro sólido de los minerales Nagyágit (mineral de hojas, AuPb (Pb, Sb, Bi) Te2-3S6) y Sylvanita (fuente, (Au, Ag) Te2). Mueller von Reichenstein sugirió que metallum problematicum "... tal vez un nuevo semi-metal aún no reconocido", quería sus hallazgos, sin embargo, solo por el mineralogista y químico sueco Torben Olof Bergman (1735-1784) confirman. En el año 1783, envió muestras del mineral a Bergman para su revisión, pero no recibió respuestas definitivas. Bergman murió 1784 y las investigaciones sobre metallum problematicum han sido descontinuadas por el momento.
No fue sino hasta doce años después, en el año 1797, que Martin Heinrich Klaproth (1743-1817) recibió muestras de los minerales de Müller von Reichenstein en Berlín. Klaproth afirmó las conclusiones de las investigaciones de Müller von Reichenstein y vio evidencia suficiente para el descubrimiento de un nuevo elemento. En enero, 1798 Klaproth elogió los méritos de Müller von Reichenstein en una conferencia y le atribuyó el descubrimiento del nuevo elemento. Como Mueller von Reichenstein no le había dado nombre al elemento, Klaproth decidió el nombre Tellurium (latín tellus: "tierra"):
Para llenar este vacío en la mineralogía química, presento aquí mis experimentos y experiencias con estos minerales preciosos, cuyo resultado principal es el descubrimiento y la validación de un nuevo metal peculiar, al que agrego el nombre Telurio prestado de la antigua Madre Tierra. "
Las piezas de mano originales del material de muestra de la localidad tipo Zlatna, que Klaproth tenía disponibles, se encuentran hoy en el Museo de Historia Natural de Berlín.
Independiente de Müller von Reichenstein y Klaproth, 1789 descubrió al químico y botánico húngaro Paul Kitaibel (1757-1817) el telurio en investigaciones de mineral de oro del pueblo minero Nagybörzsöny (Deutsch-Pilsen) en Hungría. Klaproth mencionó en su conferencia publicada, sin embargo, solo Müller von Reichenstein, aunque desde 1796 lo había hecho con un manuscrito que Kitaibels también estaba al tanto de sus investigaciones. En una carta a Kitaibel, Klaproth declaró que había perdido el contenido del manuscrito y que no había visto ninguna conexión con su trabajo en las investigaciones del mineral Müller von Reichenstein. Finalmente, Klaproth finalmente convenció a Kitaibel de que el descubrimiento del telurio debería atribuirse solo a Mueller von Reichenstein, ya que hizo las mismas observaciones sobre el nuevo elemento varios años antes.
El símbolo del elemento "Te" fue propuesto a 1814 por Jöns Jakob Berzelius (1779-1848) y todavía se usa hoy en día. La primera aclaración de la estructura del teluro cristalino con difracción de rayos X fue 1924.
Ocurrencia
El telurio es un elemento raro; su contribución a la corteza terrestre es de aproximadamente 0,01 ppm (g / t). Con el oro, subordinado a la plata, el cobre, el plomo y el bismuto, así como a los metales de platino, rara vez ocurre con dignidad, es decir, en forma elemental en la naturaleza.
El telurio sólido pertenece como un mineral al grupo de elementos, más precisamente los semi y no metales y está en la clasificación de minerales según Strunz bajo el número I / B.03-40 (edición 8) o 1.CC.10 (9. Edición), y llevó a Dana con el número 1.3.4.2.
Los rastros de grandes cantidades de selenio pueden estar contenidos en teluro sólido (selenio). Aunque el telurio es un elemento raro, se conoce un número relativamente grande de minerales porque el telurio forma sus propios minerales porque rara vez se incorpora a sulfuros o seleniuros o sulfatos o selenatos; es demasiado grande para estas redes cristalinas de homólogos más ligeros. Por el contrario, los dos homólogos más ligeros representan con mayor frecuencia telurio en sus sitios enrejados en estructuras cristalinas de minerales que contienen telurio.
El telurio muestra la mayor afinidad con el oro de todos los elementos y, por lo tanto, a menudo se encuentra en la naturaleza en forma de telururos de oro, minerales con anuros de telururo (Te2) o ditellurida (Te22-). Además del oro y otros metales preciosos, el plomo y el bismuto forman telururos más naturales, que a menudo acompañan (paragénesis) a los metales y minerales de oro dignos.
Más raros son los minerales con cationes Te4 + en la estructura cristalina, en donde el óxido de teluro más importante, el dióxido de teluro TeO2, se presenta en dos modificaciones como telurito ortorrómbico y paratellurito tetragonal en la naturaleza. Otros cationes de telurio (IV) son oxotelluratos (IV) (teluritos) que contienen aniones complejos [TeO3] 2 o [TeO4] 4. Los minerales que contienen cationes Te6 + en forma de aniones complejos octaédricos [TeO6] 6 son extremadamente raros, y los minerales 21 contienen principalmente cobre y plomo. Además de los minerales mencionados, los minerales de teluro de valencia mixta también existen en la naturaleza, incluido el oxi-telurato de calcio (IV, VI) Carlfriesite CaTe3O8 con una relación Te4 +: Te6 + de 2: 1. [14] [15] Para los minerales con Te4 + para Te6 + Los cationes son minerales secundarios que han surgido de la meteorización del telurio y el telururo.
Los minerales que contienen telurio no son importantes para la producción técnica de telurio, ya que son raros y prácticamente no hay depósitos que valgan la pena extraer. Además de la localidad tipo Zlatna (Transilvania, Rumania), los minerales ricos en telurio conocidos incluyen Moctezuma (México), Cripple Creek (Colorado), Kalgoorlie (Australia) y Calaveras (California). Hasta ahora (a partir de 2012) se conocen minerales que contienen teluro 154, de los cuales, sin embargo, cinco (dilithium, imgreit, kurilite, sztrokayite, protojoseite) aún no han sido reconocidos o desacreditados como minerales independientes por la Asociación Internacional de Mineralogía (IMA).
Extracción y presentación.
El telurio junto con el selenio se obtiene industrialmente exclusivamente a partir de subproductos de la producción de cobre y níquel electrolítico a gran escala. Las suspensiones anódicas resultantes contienen telururos y selenidos de metales nobles insolubles en agua de la fórmula general M2Ch (M = Cu, Ag, Au, Ch = Se, Te), que a temperaturas superiores a 500 ° C bajo oxígeno atmosférico (O2) con soda (carbonato de sodio Na2CO3 ) son reaccionados. Los cationes de metales nobles (M +) se reducen a metales elementales (M), que oxidan los aniones telururos a oxo-telurados (IV) (TeO32-):
Alternativamente, esta reacción también se puede llevar a cabo con ácido nítrico (nitrato de sodio NaNO3) en ausencia de aire y formación de óxidos de nitrógeno (NO y NO2):
El telurato de sodio (IV) Na2TeO3 resultante se disuelve en agua, donde reacciona básicamente y forma iones de hidrogentellurato (IV) HTeO3-. La separación de los telurados (IV) de los selenatos (IV) formados de manera similar en la solución básica mediante neutralización con la adición de ácido sulfúrico (H2SO4), que precipita en agua dióxido de teluro casi insoluble TeO2:
El dióxido de teluro se puede reducir a teluro elemental en lejías mediante electrólisis o por medios químicos mediante disolución en ácidos minerales concentrados e introducción de dióxido de azufre SO2, formando el azufre a partir de las moléculas de SO2 (o los iones de sulfito de SOxnumx formados a partir de ellos en la solución). ) y se forman iones sulfato (SO32-):
El proceso de fusión por zonas se utiliza para obtener telurio de alta pureza (> 99,9%).
La producción anual mundial de telurio aumentó de 298 toneladas en 2013 en 53% a 457 toneladas en el año 2017, promediando 382,8 toneladas por año (t / a). Los principales productores incluyen China (∅ 220,0 t / a), EE. UU. (∅ 50,0 t / a), Rusia (∅ 35,6 t / a), Suecia (∅ 32,4 t / a), Japón (∅ 31,8 t / a) y Canadá (∅ 13,0 t / a). En la tabla se muestra una descripción general de las cantidades de producción de cada país. Es probable que otras naciones industriales, como Alemania y Bélgica, produzcan telurio, pero no hay cifras disponibles. [17] El Servicio Geológico de los Estados Unidos (USGS) estima las reservas mundiales de telurio en 2019 en alrededor de 31.000 toneladas.
| CARGA TERRESTRE | 2013 | 2014 | 2015 | 2016 | 2017 | ∅ |
|---|---|---|---|---|---|---|
| China | 150 | 180 | 210 | 279 | 281 | 220,0 |
| Estados Unidos de America | 50 | 50 | 50 | 50 | 50 | 50,0 |
| Rusia | 31 | 33 | 34 | 40 | 40 | 35,6 |
| Suecia | 24 | 31 | 33 | 39 | 35 | 32,4 |
| Japón | 31 | 32 | 34 | 28 | 34 | 31,8 |
| Canadá | 12 | 9 | 9 | 18 | 17 | 13,0 |
| zumbido | 298 | 335 | 370 | 454 | 457 | 382,8 |
 |
||||||
modificaciones
Telurio cristalino
En condiciones estándar, solo se conoce una modificación cristalina (Te-I o α-Te) del teluro, que se conoce como teluro cristalino o metálico. Es isotípico para el α-selenio, es decir, tiene la misma estructura cristalina. En el sistema de cristal trigonal en el grupo espacial P3121 (No. 152), el teluro cristaliza con los parámetros de red a = 446 pm yc = 592 pm y tres unidades de fórmula en la celda unidad (unidad más pequeña de la estructura cristalina).
El grupo espacial P3121 (No. 152), descrito según el simbolismo de Hermann Mauguin, explica el centrado de la celda unitaria y los elementos de simetría existentes. P significa que la red de Bravais es primitiva. La información sobre el centrado es seguida por los elementos de simetría existentes del grupo espacial: 31 describe un eje de tornillo triple (multiplicación de una partícula por rotación por 120 ° y desplazamiento (traslación) por 1/3 en la dirección del eje de rotación) paralelo al eje c cristalográfico ([001] ), 2 describe un doble eje de rotación (multiplicación por rotación por 180 °) paralelo a los tres ejes a cristalográficos (<100>), 1 el elemento de simetría del eje único de simetría o identidad (multiplicación por rotación por 360 °, por lo que se forma la partícula sobre sí mismo) en la dirección perpendicular a los ejes a y c (<120>).
La estructura cristalina contiene solo un átomo de telurio distinguible cristalográficamente con las coordenadas de posición x = 0,2636, y = 0 y z = 1 / 3. Todos los demás átomos de la estructura cristalina pueden atribuirse a este átomo por los elementos de simetría existentes del grupo espacial. Dado que el átomo de teluro coincide en su posición con el eje de simetría doble del grupo espacial (P3121 (No. 152)), se multiplica exclusivamente por el eje del tornillo triple (31). Esto da como resultado cadenas helicoidales de átomos de teluro unidos covalentemente paralelos al eje c. Los átomos de telurio están separados por la cadena 284 pm, el ángulo de enlace es 103,1 °. Los enlaces dentro de la cadena están resaltados en rojo en las ilustraciones, una cadena se muestra en azul para mayor claridad, con el átomo azul oscuro en z = 1 / 3, el azul central en z = 2 / 3 y el azul claro en z = 1 o z = 0 está ubicado. Cada tercer átomo dentro de la cadena es por lo tanto congruente. Cada cadena está rodeada por seis cadenas más. Los enlaces de Van der Waals existen entre las cadenas con distancias Te-Te de 349 pm (mostradas en líneas discontinuas verdes), que resultan de caer por debajo del radio de van der Waals (2 · 206 pm = 412 pm) de los átomos de teluro , Para un solo átomo de telurio se obtiene un número de coordinación de 6, más precisamente 2 + 4, ya que los átomos de 2 provienen de la misma cadena y, por lo tanto, tienen una distancia menor que los otros 4 de las cadenas vecinas. Como poliedro de coordinación, esto da como resultado un octaedro distorsionado (resaltado en amarillo).
El telurio también puede cristalizar en el grupo espacial P3221 (# 154) en lugar de P3121 (# 152). El eje del tornillo 32 también duplica un átomo al girarlo alrededor de 120 °, pero luego lo desplaza por 2 / 3 en lugar de 1 / 3 en la dirección del eje de rotación. Esto también crea cadenas helicoidales que se enrollan en sentido horario en lugar de hacerlo en sentido antihorario (en el eje del tornillo 31) a lo largo del eje C. La estructura cristalina en el grupo espacial P3221 (No. 154) ("izquierda") es, por lo tanto, la imagen especular de la estructura en el grupo espacial P3121 (No. 152) ("forma legal"). La aparición de formas cristalinas de imagen especular se llama enantiomorfismo en cristalografía.
El sistema de cristal de telurio a menudo se denomina hexagonal. El sistema de cristal hexagonal y trigonal se basa en la misma celda unitaria, pero una simetría hexagonal requeriría la presencia de un eje de simetría de seis veces (6, multiplicación de una partícula por rotación sobre 60 °). La estructura cristalina del telurio, sin embargo, contiene solo el eje del tornillo triple (31) y, por lo tanto, pertenece sin duda al sistema de cristal trigonal simétrico inferior.
En experimentos de alta presión con teluro cristalino (Te-I o α-telurio) se descubrieron modificaciones adicionales. Los rangos de presión especificados para la estabilidad de las modificaciones varían en parte en la literatura:
- Te-II cristaliza en el sistema de cristal monoclínico en el rango de presión de 4 a 6,6 GPa. C2 / m (No. 12) y P21 (No. 4) se mencionan en la literatura como posibles grupos espaciales.
- Te-III cristaliza en el sistema de cristal ortorrómbico y es estable en el rango de presión por encima de 6,6 GPa. Para una modificación ortorrómbica, existe un cálculo teórico en el grupo espacial Imma (No. 74).
- Te-IV cristaliza en el sistema de cristal trigonal en el grupo espacial R3m (No. 166) y corresponde a la estructura del β-polonio. Es estable en el rango de presión de 10,6 a 27 GPa. Las distancias de los átomos de telurio dentro de las cadenas y a las cadenas adyacentes en esta modificación son las mismas y equivalen a 300 pm, lo que resulta en una simetría más alta en comparación con α-Te.
- Te-V es estable por encima de 27 GPa. Para esta modificación, se supone una red centrada en un cuerpo cúbico (grupo espacial Im3m (# 229)).
Telurio amorfo
La modificación amorfa inestable es un polvo marrón y puede prepararse a partir de ácido telúrico (H2TeO3) por reacción con ácido sulfuroso (H2SO3) o iones sulfito (SO32-). Los iones sulfito se oxidan a iones sulfato (SO42-) mientras que los cationes Te4 + se reducen a teluro elemental:
El telurio amorfo se convierte lentamente en modificación cristalina en condiciones estándar.
Propiedades fisicas
El telurio cristalino es un semiconductor directo intrínseco con un intervalo de banda de 0,334 eV. Al igual que con todos los semiconductores, la conductividad eléctrica se puede aumentar al aumentar la temperatura o la exposición, pero esto solo conduce a un ligero aumento en el teluro. La conductividad eléctrica y la conductividad térmica se comportan direccionalmente dependiendo del telurio, que es anisotrópico. El telurio cristalino es un material blando (Mohs 2,25) y quebradizo que es fácil de procesar en polvo. Al aumentar la presión, el telurio se transforma en modificaciones cristalinas adicionales. Por encima de 450 ° C, el telurio pasa a una masa roja, y a temperaturas superiores a 990 ° C, el telurio está presente como un gas diamagnético amarillo de las moléculas de Te2. A temperaturas superiores a 2000 ° C, las moléculas de Te2 se descomponen en átomos individuales.
Propiedades quimicas
El teluro cristalino es insoluble en agua y poco soluble en los ácidos minerales ácido clorhídrico y ácido sulfúrico y en los álcalis. Por otro lado, es muy soluble en ácido nítrico, ya que es un agente oxidante muy fuerte y oxida el telurio elemental para formar teluros con el estado de oxidación estable + IV. El telurio derrite el cobre, el hierro y el acero inoxidable.
En compuestos con no metales, el telurio se comporta como el miembro del grupo más ligero, el selenio. En el aire arde en una llama azul con líneas verdes para dar dióxido de teluro TeO2:
El telurio reacciona espontáneamente con halógenos para formar haluros de teluro. Notablemente, en contraste con los homólogos más ligeros selenio y azufre, el teluro también forma yoduros termodinámicamente estables, incluido el yoduro de teluro TeI con el estado de oxidación + I. Con metales básicos como el zinc, reacciona violentamente a los telururos correspondientes.
isótopo
El telurio es conocido por los isótopos numerados en masa entre 105 y 142. El telurio natural es un elemento mixto que consta de ocho isótopos, de los cuales cinco (122Te, 123Te, 124Te, 125Te, 126Te) son estables. El isótopo 123Te debería decaer teóricamente a 123Sb bajo captura de electrones. Sin embargo, esta descomposición aún no se ha observado; el límite inferior para su vida media es 9,2 · 1016 años (92 cuatrillones de años). El isótopo 120Te pasa directamente a 120Sn a través de la captura doble de electrones. Los isótopos 128Te y 130Te se convierten en 128Xe y 130Xe, respectivamente, por emisión de radiación beta (doble desintegración beta).
El principal contribuyente al telurio natural es aproximadamente un tercio del isótopo 130Te con una vida media de 7,9 · 1020 años, seguido del isótopo 128Te. La masa atómica promedio de los isótopos naturales de telurio es, por lo tanto, 127,60, que es más grande que la del elemento yodo puro con 126,90 que sigue en la tabla periódica. 128Te se considera el isótopo con la descomposición más lenta de todos los isótopos no estables de todos los elementos. La descomposición extremadamente lenta con una vida media de 7,2 · 1024 años (7 cuatrillones de años, es decir, en kilogramos 1, un átomo decae cada 18 meses) solo se pudo determinar mediante la detección del producto de descomposición (128Xe) en muestras muy antiguas de teluro natural.
De los otros isótopos, el isómero central 121mTe tiene la vida media más larga con días 154. También para los isótopos 127Te y 129Te, las vidas medias de los isómeros están por encima de las del estado fundamental. El marcador más utilizado es el isótopo 127Te, seguido de 121Te. Los isótopos 127Te y 129Te también se presentan como productos de fisión en la fisión nuclear en reactores nucleares.
Utilizar
El telurio es un elemento técnicamente menos importante porque es caro de fabricar y otros elementos o compuestos suelen ser equivalentes en su uso. En 2016 se demostró el comportamiento termoeléctrico de telurio elemental, policristalino y dopado con una alta figura de mérito en el rango entre temperatura ambiente y 400 ° C. El telurio elemental se utiliza en la industria del metal como aditivo (<1%) para acero, hierro fundido, aleaciones de cobre y plomo y en aceros inoxidables. Promueve la resistencia a la corrosión y mejora las propiedades mecánicas y la maquinabilidad. Hasta ahora, el telurio puro se ha utilizado sólo en raras ocasiones como semiconductor; el telurio se utiliza principalmente en semiconductores compuestos II-VI. El telururo de cadmio CdTe es z. B. utilizado en fotodiodos y células solares de película delgada para generar electricidad a partir de la luz.
El telururo de bismuto Bi2Te3 se utiliza en termopares para generar electricidad en generadores termoeléctricos (por ejemplo, en baterías de radionúclidos) o en elementos Peltier para enfriamiento.
Las combinaciones de germanio GeTe y telururo de antimonio Sb2Te3 se utilizan en materiales de cambio de fase como parte de los discos ópticos de almacenamiento (por ejemplo, CD-RW) o en nuevos materiales de almacenamiento como la memoria de acceso aleatorio de cambio de fase.
Debido a sus altos índices de refracción, se usan vidrios de dióxido de teluro de TeO2 en lugar de vidrio de sílice SiO2 en guías de ondas ópticas.
En microbiología, el agar mixto incoloro de potasio (IV) K2TeO3 se utiliza como medio nutritivo selectivo para la detección de estafilococos y Corynebacterium diphtheriae. Las colonias bacterianas aparecen como pequeñas esferas negras, ya que reducen los cationes Te4 + a teluro elemental y los almacenan en sus células.
El telurio (o telurato de potasio) se utilizó por primera vez con fines medicinales por 1890 para el tratamiento de la sudoración nocturna en pacientes con tuberculosis.
Además, pequeñas cantidades de telurio se utilizan para la vulcanización del caucho, en detonadores y para el teñido de vidrio y cerámica. Las sales de telurio se utilizan en parte para producir un color verde hierba en los fuegos artificiales.
Instrucciones de seguridad y toxicidad.
En forma soluble, el telurio es un elemento venenoso para el organismo humano y, por lo tanto, fue clasificado como venenoso en el pasado. Sin embargo, dado que el telurio elemental es muy poco soluble en agua y en los propios ácidos del cuerpo, se ha degradado a nocivo. Los estudios de la Organización de los Países Bajos para la Investigación Científica Aplicada (TNO) mostraron que el valor de LD50 (oral) para ratas es> 5000 mg / kg. El valor de 83 mg / kg que figura en muchas fichas de datos de seguridad del libro Toxicometric Parameters of Industrial Toxic Chemicals under single Exposure de NF Ismerow, que data de 1982, [26] sólo se aplica a los compuestos de telurio fácilmente solubles. A pesar de esto, varios fabricantes continúan usando el antiguo valor LD50 para el telurio elemental (polvo) y la clasificación tóxica en relación con la frase H 301 ("Tóxico en caso de ingestión").
El telurio no es tan tóxico como el selenio. Esto es análogo a los elementos vecinos de 5. Grupo principal, donde el antimonio también es menos tóxico que el arsénico. Si el telurio, especialmente en forma de compuestos de teluro fácilmente solubles, como los teluratos de metales alcalinos (por ejemplo, Na2TeO3) por ingestión (peroral) en el cuerpo, se forma por reducción tóxica dimetiltellurida (Me2Te: H3C-Te-CH3), que causa daño a la sangre, el hígado Puede causar corazón y riñón. Dado que los compuestos de telurio fácilmente solubles liberan mucho más telurio, también se clasifican como más peligrosos. La intoxicación por telurio se manifiesta en un intenso olor a ajo de aire respirable, causado por dimetiltellurida, primero por Christian Gottlob Gmelin, 1824 (por sus primeros estudios sobre el efecto del telurio en los seres vivos). Esto tomará varias semanas para desarrollarse y desarrollarse incluso a niveles muy bajos, que no causan envenenamiento grave. Este olor a ajo, a diferencia del ajo real, no se puede eliminar cepillándose los dientes. También se instala en una habitación y solo se aleja después de varias horas. También se excreta lentamente a través de la piel.
Los polvos de telururo pueden encenderse espontáneamente en el aire y, cuando se distribuyen finamente en una concentración correspondiente, también pueden reaccionar explosivamente, formando en cada caso dióxido de teluro TeO2. Al igual que otros polvos metálicos, el polvo de teluro también puede reaccionar explosivamente con compuestos interhalógenos como el pentafluoruro de bromo BrF5. No se ha establecido una concentración máxima en el lugar de trabajo (MAK) para el telurio.
prueba
El telurio elemental se puede detectar en ácido sulfúrico concentrado caliente (H2SO4) mediante la oxidación del teluro para formar el catión rojo Te42 + (dicación tetratelúrica). Parte del ácido sulfúrico se reduce en la reacción al ácido sulfúrico (H2SO3), que se descompone debido a las altas temperaturas en el agua (H2O) y su anhídrido dióxido de azufre (SO2), que escapa como gas:
El color del catión Te42 + cuadrado-plano se debe a seis electrones π deslocalizados que absorben parte de la luz visible. El resto de las longitudes de onda no absorbidas de luz dan el color complementario rojo.
El telurato y la telurita pueden especificarse por medio de la polarografía, es decir, selectivamente determinados uno al lado del otro. Mientras que el nivel de telurato es -1,66 V, el de telurito aparece en -1,22 V (vs. SCE, soda cáustica 0,1 M). Ambas especies de telurio se reducen en un solo paso a telururo. Los rastros de 0,03% tellurate o 0,003% tellurite son detectables de esta manera. Significativamente más fuertes son los métodos de espectroscopía atómica. Mientras que la llama AAS alcanza un límite de detección de 20 μg / l, este valor es mucho más bajo para el tubo de grafito AAS (0,2 μg / l) y la técnica de hidruro (0,02 μg / l).
telurio
En los compuestos, el telurio ocurre con mayor frecuencia en los estados de oxidación -II (telururos) y + IV (tetrahaluros, dióxido de telurio y teluratos (IV), teluritos obsoletos). Más raros son los estados de oxidación + VI (telurados (VI)) y + II (dihaluros) así como -I (ditelluridas) y + I (monohaluros, solo conocidos como TeI).
compuestos de hidrógeno
El hidrógeno telúrico H2Te es un gas incoloro y altamente tóxico producido por la reacción de telururos (MxTey) con ácidos fuertes, como el ácido clorhídrico HCl. A partir de los elementos (hidrógeno y teluro), el compuesto puede representarse como un compuesto fuertemente endotérmico solo a temperaturas superiores a 650 ° C. Disuelto en agua (ácido telúrico), reacciona ácido, la acidez corresponde aproximadamente al ácido fosfórico. En el aire, la solución acuosa se descompone inmediatamente en agua y teluro elemental.
compuestos oxigenados
Dióxido de telurio (óxido de telurio (IV)) TeO2 es un sólido cristalino incoloro y el óxido de telurio más importante. Es el resultado de la combustión de telurio elemental con aire. Es el anhídrido del ácido telúrico débilmente anfótero e inestable H2TeO3. El dióxido de telurio existe en una modificación ortorrómbica (telurita) y una modificación tetragonal (paratellurit), que también ocurren en la naturaleza como minerales.
Trióxido de telurio (óxido de telurio (VI)) TeO3 es un sólido cristalizador amarillo, trigonal / romboédrico y el anhídrido del ácido ortotelúrico H6TeO6. Resulta del drenaje del ácido ortotelúrico por un fuerte aumento de la temperatura. El color amarillo se debe a la transferencia electrónica del oxígeno al telurio ("transferencia de carga").
El monóxido de teluro (óxido de teluro (II)) TeO es otro, pero en condiciones estándar óxido de teluro inestable. Se describe como un sólido amorfo negro y reacciona en el aire húmedo con oxígeno para formar el dióxido de teluro más estable TeO2.
El pentóxido dicelular (óxido de teluro (IV) teluro (VI)) es un óxido de teluro mezclado con los cationes Te4 + y Te6 +. Además del trióxido de telurio, otro producto en la descomposición térmica del ácido ortotelúrico y cristalizado en el sistema de cristales monoclínicos.
Los teluratos son las sales del ácido ortotelúrico H6TeO6 y el ácido metatelúrico H2TeO4 con los aniones [TeO6] 6- o [TeO4] 2-. Las sales del ácido telúrico H2TeO3 con el anión [TeO3] 2- se llaman teluratos (IV) (teluritos obsoletos).
compuestos halogenados
Los tetrahaluros TeX4 con teluro en el estado de oxidación + IV son los haluros de teluro más comunes. Estos son conocidos con todos los halógenos (flúor, cloro, bromo y yodo). Todos los compuestos son sólidos cristalinos.
Los dihaluros TeX2 con teluro en el estado de oxidación + II se conocen solo con cloro, bromo y yodo, solo existen en la fase gaseosa.
Los monohaluros TeX existen de telurio solo con yodo como yoduro de telurio TeI. Es el único mono-yoduro termodinámicamente estable de calcógenos y un sólido cristalino oscuro. El telurio en este compuesto tiene el estado de oxidación inusual + I.
Los subhaluros contienen Te con un estado de oxidación que es menor que + I. Los representantes estables son Te2I, Te2Br y Te3Cl2.
Las hexahalidas TeX6 con teluro en el estado de oxidación + VI se conocen solo como hexafluoruro de teluro TeF6 o cloruro de pentafluoruro de teluro TeF5Cl. Ambos son gases incoloros. El hexafluoruro de telurio es el hexafluoruro de calcógeno más reactivo (además del hexafluoruro de azufre SF6 y el hexafluoruro de selenio SeF6) y es el único que se hidroliza en agua.
Además, el telurio en el estado de oxidación + IV en solución acuosa también compuestos complejos [TeX6] 2- (X = F-, Cl-, Br-, I-) con todos los iones de haluro. Con la excepción del complejo hexafluoro, todos los demás tienen una estructura perfectamente octaédrica y también pueden precipitarse como sales de la solución (por ejemplo, hexacloridotellurato de amonio amarillo (IV) (NH4) 2 [TeCl6], hexabromidotellurato de amonio marrón rojizo (IV) (NH4) 2 [TeBr6] o hexaiodidotellurato de cesio negro (IV) Cs2 [TeI6]).
conexiones Organotellurium
El telurio forma una serie de compuestos organometálicos. Sin embargo, estos son muy inestables y se usan poco en síntesis orgánica. Como teluro puro, los compuestos organilo de la forma R2Te, R2Te2, R4Te y R6Te (R son cada uno alquilo, arilo).
Además, también se conocen dihaluros de diorganotellur R2TeX2 (R = alquilo, arilo, X = F, Cl, Br, I) y triorganotellurhaluros R3TeX (R = alquilo, arilo, X = F, Cl, Br, I).
Tellurpolykationen
Polycation Te72+ en Te7[Sea2Cl6]
Mediante la oxidación cuidadosa del teluro, además del Te42 + ya mencionado, se pueden preparar numerosos policationes de teluro Tenx + y cristalizar con un contraión adecuado. El contraión debe ser una base de Lewis débil ya que los policationes de teluro son ácidos de Lewis relativamente fuertes. Los agentes oxidantes adecuados son a menudo haluros de los metales de transición, que a temperaturas típicamente de 200 ° C dan directamente el compuesto deseado:
Con frecuencia, la cristalización es exitosa bajo las condiciones de transporte químico, pero a veces se deben usar solventes anhidros como cloruro de estaño o tetrabromuro de silicio. En ciertos casos, las sales fundidas también son medios de reacción adecuados. Si el haluro metálico no es un agente oxidante adecuado, como es generalmente el caso con los haluros de los elementos del grupo principal, los tetrahaluros de teluro correspondientes pueden usarse como agentes oxidantes:
Al variar el contraión y el medio de reacción, se podría representar una amplia variedad de policationes; Los policationes mixtos de selenio-telurio también son accesibles mediante la elección adecuada de los reactivos de la síntesis. Además de los policationes en cadena o en forma de banda que se muestran, también hay policationes aislados como Te62 +, Te64 + y Te84 +.
Precio del telurio
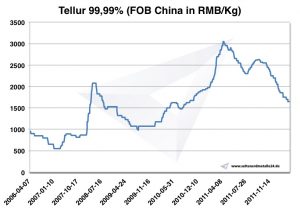
Gráfico Telurio 2006-2011
Precios del telurio -> precios de metales estratégicos










![{\ mathrm {8 \ Te \ + \ 2 \ UBr_ {5} \ longrightarrow \ Te_ {8} [U_ {2} Br _ {{10}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/766123b2cbd2af42e846172c00731419fb95bc1b)
![{\ mathrm {13 \ Te \ + \ TeCl_ {4} \ + \ 4 \ BeCl_ {2} \ longrightarrow \ 2 \ Te_ {7} [Be_ {2} Cl_ {6}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1d391160b6e1fdb357b4a11ea7abd720a1cb0ba)
