Circonio, Zr, número atómico 40
Precio de circonio, ocurrencia, extracción y uso
Circonio, a menudo también circonio, es un elemento químico con el símbolo del elemento Zr y el número ordinal 40. Su nombre deriva del circonio, el mineral de circonio más común. En la tabla periódica está en el 5. período; Es el segundo elemento de 4. Grupo (subgrupo 4 obsoleto) o grupo titán. El circonio es un metal pesado muy resistente a la corrosión. Las funciones biológicas son desconocidas; Está presente en pequeñas cantidades (4 mg / kg) en el organismo humano y no es tóxico.
El importante mineral circón que contiene circonio (Zr [SiO4]) se conoce como piedra preciosa desde la antigüedad. El circonio como elemento fue descubierto por Martin Heinrich Klaproth en 1789 en una muestra del mineral circón de Ceilán y recibió su nombre. El metal fue presentado por primera vez en 1824 por Jöns Jakob Berzelius a través de una reducción de K.2ZRF6 con potasio. Para hacer esto, calentó "Una mezcla de potasio de circonio fluorhídrico con potasio en un tubo de hierro". Después del tratamiento con agua, secado y calentamiento prolongado con ácido clorhídrico diluido, Berzelius recibió una "Polvo grumoso que parece negro de carbón" era y solo "Al exprimir con el acero pulido un color gris oscuro y brillo" recibido. La masa atómica correcta, por otro lado, no se pudo determinar hasta 1924 porque, además de errores en la implementación de los experimentos, no se sabía que el circonio siempre contiene pequeñas cantidades de hafnio. Sin esta información, las mediciones siempre dieron una masa atómica ligeramente demasiado alta. La primera aplicación práctica del circonio fue como polvo flash sin humo.
Ocurrencia
El circonio se produce en la corteza terrestre con un contenido de aproximadamente 0,016%. En la lista ordenada de elementos de frecuencia, el circonio está en 18. Coloca y es más común que los elementos más familiares de cloro y cobre. Aunque está muy extendido, generalmente se encuentra solo en cantidades muy pequeñas y en cristales muy pequeños (generalmente alrededor de 0,1 mm). Por lo tanto, el circonio se ha considerado raro en la antigüedad. El circonio se encuentra principalmente en rocas intrusivas de silicato como el granito. No viene digno, sino solo en algunos minerales, especialmente como el circón (ZrSiO4) y Baddeleyit (ZrO2) y el rojo eudialyte más raro (Na4(CaCeFeMn)2ZrSi6O17(OHCl)2) Casi siempre se asocia con hafnio. Debido a su alto punto de fusión de 2550 ° C, su alta dureza y baja reactividad, el circonio es el mineral más antiguo que se puede encontrar en la tierra y puede usarse para determinaciones de edad radiométrica basadas en isótopos de uranio y torio incrustados.
Los depósitos secundarios, los llamados depósitos de jabón, se utilizan normalmente como materias primas. Estos ocurren cuando la roca circundante se erosiona y solo queda el circón particularmente resistente a la intemperie. Otros depósitos de este tipo pueden surgir de las corrientes de agua que lavan los cristales de circonio y los lavan en otros lugares. Los depósitos primarios, por otro lado, generalmente tienen un contenido de circonio que es demasiado bajo para una minería rentable.

Desarrollo temporal de la promoción de circón.
Los depósitos de circonio más importantes se encuentran en Australia, Estados Unidos y Brasil. Con reservas recuperables de 38 millones de toneladas, la producción mundial anual de minerales de circonio 2006 fue de 920.000 toneladas (calculada como circonio). De estos, solo alrededor del 5% se procesan en metal y aleaciones. Los principales países productores fueron 2006, con mucho, Australia y Sudáfrica.
Extracción y presentación.
El circonio, la materia prima de circonio más común, primero debe convertirse en dióxido de circonio antes de su posterior procesamiento. Para esto, el circón se hierve en una mezcla de hidróxido de sodio (digestión alcalina). Luego, la circonia se hace reaccionar con coque en el arco para formar carbonitruro de circonio (circonio que contiene carbono y nitrógeno) y luego con cloro para formar tetracloruro de circonio.

No es posible una reducción directa de dióxido de circonio con carbono (como en el proceso de alto horno), ya que los carburos formados son muy difíciles de separar del metal. En cambio, el tetracloruro de circonio se reduce a circonio metálico en el llamado proceso Kroll con magnesio en una atmósfera de helio.

El proceso de Van-Arkel-de-Boer se utiliza para obtener circonio más puro. Durante el calentamiento al vacío, el circonio reacciona inicialmente con el yodo para formar yoduro de circonio (IV). Esto se descompone nuevamente en circonio y yodo en un alambre caliente:

Se forma tetrayoduro de circonio a partir de circonio y yodo a 200 ° C; se desintegra nuevamente a 1300 ° C.
El circonio y el hafnio no se pueden separar de una manera química simple. Por lo tanto, incluso este circonio de alta pureza todavía contiene hafnio. Dado que es importante para muchas aplicaciones en la tecnología de reactores que el circonio ya no contenga hafnio, los procesos de separación para estos dos metales juegan un papel importante. Una posibilidad son los métodos de extracción en los que se explota la diferente solubilidad de los compuestos de circonio y hafnio en solventes especiales. Con frecuencia, se explotan los tiocianatos y su diferente solubilidad en metil isobutil cetona. Otras posibilidades son los intercambiadores de iones o la destilación fraccionada de compuestos adecuados.
Propiedades
Propiedades fisicas

Estructura cristalina de α-circonio
El circonio es un metal pesado plateado brillante (densidad 6,501 g / cm3 a 25 ° C), externamente se parece al acero. El metal cristaliza en dos modificaciones diferentes en las que se puede convertir por cambio de temperatura. Por debajo de 870 ° C cristaliza el α-circonio en el sistema de cristal hexagonal (empaque de esfera densa hexagonal, tipo magnesio) en el grupo espacial 6/ mmm con los parámetros de cuadrícula a = 323 pm yc = 514 pm, así como dos unidades de fórmula por celda unidad. A 870 ° C, la estructura cristalina cambia a la estructura β centrada en el cubo (tipo tungsteno) con el grupo espacial  y el parámetro de celosía a = 361 pm.
y el parámetro de celosía a = 361 pm.
El circonio es relativamente blando y flexible. Se puede procesar fácilmente mediante laminado, forjado y martilleo. Sin embargo, se vuelve frágil y difícil de procesar debido a los bajos niveles de contaminación de hidrógeno, carbono o nitrógeno en el metal. La conductividad eléctrica no es tan buena como la de otros metales. Es solo alrededor del 4% del cobre. En contraste, el circonio es un buen conductor de calor. El punto de fusión y el punto de ebullición son ligeramente más altos en comparación con el titanio homólogo más ligero (punto de fusión: titanio: 1667 ° C, circonio: 1857 ° C). Además, la conductividad eléctrica y térmica son mejores. Debajo de 0,55 K, el circonio se vuelve superconductor.
Las propiedades del circonio y el homólogo más pesado del hafnio son muy similares debido a la contracción del lantánido. Esto requiere radios atómicos similares (Zr: 159 pm, Hf: 156 pm) y, por lo tanto, propiedades similares. Los dos metales difieren considerablemente en su densidad (Zr: 6,5 g / cm3, Hf: 13,3 g / cm3).
Una propiedad importante, debido a la cual el circonio ha ganado gran importancia en la construcción de reactores, es su pequeña sección transversal de captura de neutrones. En esta propiedad, el circonio también es muy diferente del hafnio. Esto hace que el complejo proceso de separación sea necesario para estas aplicaciones.
Propiedades quimicas
El circonio es un metal base que reacciona con muchos no metales, especialmente a altas temperaturas. Principalmente como un polvo, arde con una llama blanca para formar dióxido de circonio, y en presencia de nitrógeno también para formar nitruro de circonio y oxinitruro de circonio. El metal compacto solo reacciona con oxígeno y nitrógeno cuando es calor blanco. A mayor presión, el circonio reacciona con el oxígeno incluso a temperatura ambiente, ya que el óxido de circonio formado es soluble en el metal fundido.
El circonio se pasiva en el aire mediante una capa fina y muy densa de óxido de circonio y, por lo tanto, es inerte. Por lo tanto, es insoluble en casi todos los ácidos, solo el agua regia y el ácido fluorhídrico atacan el circonio a temperatura ambiente. Las bases acuosas no reaccionan con el circonio.
isótopo
Hay muchos isótopos del circonio entre 78Zr y 110Zr conocido. El circonio natural es un elemento mixto que consta de cinco isótopos. Estos son 90Zr, que ocurre con mayor frecuencia con una proporción del 51,45% de circonio natural, así como los isótopos más pesados 91Zr (11,32%), 92Zr (17,19%), 94Zr (17,28%) y 96Zr con una participación del 2,76%. 96El Zr es el único isótopo natural débilmente radiactivo; se desintegra con una vida media de 24 · 1018 Años bajo doble desintegración beta 96Mo. El isótopo 91El Zr puede detectarse con la ayuda de espectroscopia de RMN.
Utilizar
 Un uso importante para el circonio son los depósitos de celdas de combustible de uranio de Zircaloy en las centrales nucleares. Esta aleación consiste en aproximadamente 90% de circonio y pequeñas cantidades de estaño, hierro, cromo o níquel, pero no debe contener hafnio. La razón para elegir este elemento es la sección transversal de baja captura ya descrita para neutrones térmicos con alta resistencia a la corrosión, lo que lo hace también adecuado como material de construcción para plantas químicas, especialmente para piezas de aparatos especiales como válvulas, bombas, tuberías e intercambiadores de calor. Como una adición de aleación al acero, también aumenta la resistencia a la corrosión. Los instrumentos quirúrgicos se fabrican con aleaciones apropiadas.
Un uso importante para el circonio son los depósitos de celdas de combustible de uranio de Zircaloy en las centrales nucleares. Esta aleación consiste en aproximadamente 90% de circonio y pequeñas cantidades de estaño, hierro, cromo o níquel, pero no debe contener hafnio. La razón para elegir este elemento es la sección transversal de baja captura ya descrita para neutrones térmicos con alta resistencia a la corrosión, lo que lo hace también adecuado como material de construcción para plantas químicas, especialmente para piezas de aparatos especiales como válvulas, bombas, tuberías e intercambiadores de calor. Como una adición de aleación al acero, también aumenta la resistencia a la corrosión. Los instrumentos quirúrgicos se fabrican con aleaciones apropiadas.
Dado que el circonio reacciona con pequeñas cantidades de oxígeno y nitrógeno, se puede utilizar como material absorbente en lámparas incandescentes y sistemas de vacío para mantener el vacío. Esta propiedad también se utiliza en metalurgia para eliminar oxígeno, nitrógeno y azufre del acero.
Debido a su capacidad para emitir una luz muy brillante cuando se quema, se utilizó además del magnesio como polvo instantáneo. A diferencia del magnesio, el circonio tiene la ventaja de ser libre de humo. Esta característica también se explota en fuegos artificiales y luces de señalización.
El circonio emite una oleada de chispas cuando golpea superficies metálicas y es inflamable. El ejército usa esto en algunos tipos de municiones, como la munición especial de escopeta Dragon's Breath y la bomba de planeo universal estadounidense AGM-154 JSOW. En la tecnología de películas, este efecto se utiliza para efectos de impacto no pirotécnicos de, por ejemplo, balas en superficies metálicas.
Las aleaciones de circonio-niobio son superconductoras y permanecen así incluso cuando se aplican fuertes campos magnéticos. Por lo tanto, se utilizan para imanes superconductores.
Además de los alumbre que contienen aluminio, las sales de circonio se utilizan en el "curtido blanco" de las pieles.
seguridad
No se conocen efectos tóxicos del circonio y sus compuestos. Debido a la densa capa de óxido, el circonio compacto no es inflamable. En forma de polvo, por otro lado, puede comenzar a arder cuando se calienta en el aire. Los incendios de circonio son muy peligrosos ya que no pueden usarse para extinguir agua (reacción vigorosa con formación de hidrógeno), ni dióxido de carbono o halón. Los incendios de circonio deben extinguirse con extintores de metal (clase D) o arena seca.
prueba
Con Alizarin Red-S, el ácido de circonio forma un compuesto rojo-violeta característico (lago de color), que desaparece al agregar iones de fluoruro para formar el complejo de fluoruro de circonio. Esta reacción puede servir como detección cualitativa tanto de circonio como de flúor. Dado que incluso pequeñas cantidades de fluoruro (y otros aniones) interfieren, esta detección no es adecuada para el análisis de minerales. Además, algunos otros compuestos orgánicos, como tanino, Kupferron, ácido fenilarsónico, oxina o naranja de xilenol, son adecuados como reactivo de detección. Otro compuesto característico es el cloruro de circonio ZrOCl2 · 8 H2O, que cristaliza en agujas típicas. En el análisis moderno, el circonio se puede detectar mediante espectrometría de absorción atómica (AAS) o espectrometría de masas (también mediante el patrón de isótopos).
Una posibilidad para el análisis cuantitativo es la precipitación de hidróxido de circonio escasamente soluble con amoníaco y la posterior calcinación a circonia.

- Precipitación del hidróxido.
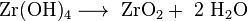
- Traslado al molde de pesaje.
Conexiones
Como metal base, el circonio forma una multitud de compuestos. La mayoría de los compuestos de circonio son sales. A menudo son muy estables y tienen un alto punto de fusión. Se prefiere el estado de oxidación + IV y es el más estable. Pero también hay compuestos en los estados de oxidación + III a + I, y en complejos incluso en los estados 0, −I y −II.
zirconia
 El compuesto de circonio más importante es el dióxido de circonio ZrO.2, un óxido muy estable y refractario. El dióxido de circonio se utiliza para producir revestimientos refractarios en crisoles y hornos. Sin embargo, para usarlo, debe estabilizarse con calcio, itria o magnesia para estabilizar la fase cúbica de alta temperatura. Además, se usa como abrasivo y debido al color blanco como pigmento blanco para la porcelana.
El compuesto de circonio más importante es el dióxido de circonio ZrO.2, un óxido muy estable y refractario. El dióxido de circonio se utiliza para producir revestimientos refractarios en crisoles y hornos. Sin embargo, para usarlo, debe estabilizarse con calcio, itria o magnesia para estabilizar la fase cúbica de alta temperatura. Además, se usa como abrasivo y debido al color blanco como pigmento blanco para la porcelana.
Los cristales de dióxido de circonio son incoloros y tienen un alto índice de refracción. Es por eso que se les conoce como zirconia como piedra preciosa artificial y sustituto de los diamantes.
Si se mezcla óxido de circonio con óxido de itrio, surgen más posibilidades de aplicación. Con un contenido de óxido de itrio del tres por ciento, el ZrO2 estabilizado en una estructura de fluorita distorsionada. Como resultado, actúa como conductor de iones de oxígeno a temperaturas superiores a 300 ° C. Una aplicación importante para esto es la sonda Lambda en automóviles, que se utiliza para medir el contenido de oxígeno en los gases de escape del catalizador. Con un contenido de 15% de itria, la circonia emite una luz blanca muy brillante a 1000 ° C. Esto se usa en la llamada aplicación de lámpara Nernst. Dado que las cerámicas de itrio-circonio tienen una resistencia a la fractura extremadamente alta, se utilizan, por ejemplo, en odontología como un marco de coronas y puentes altamente estable, en articulaciones artificiales de cadera e implantes dentales o como elemento de conexión en telescopios. En el proceso, están reemplazando cada vez más el oro y otros metales en su función.
El óxido de circonio también se usa a menudo para rodamientos de bolas. Especialmente para las pistas de rodamientos, ZrO2 la gran ventaja de que el coeficiente de dilatación térmica se acerca al del acero. Otras cerámicas técnicas como el nitruro de silicio suelen tener un coeficiente de expansión térmica considerablemente más bajo.
haluros
El circonio forma varias series de compuestos con los halógenos flúor, cloro, bromo y yodo. Todos los halógenos son compuestos de la forma ZrX4, ZrX3 y ZrX2 conocido. Además están los cloruros, bromuros y yoduros de la forma ZrX. Los tetrahaluros de la forma ZrX son los más estables.4, Se sabe que ninguno de los haluros de circonio tiene aplicaciones importantes, siendo los cloruros de circonio intermedios en la preparación de circonio puro.
Otros compuestos de circonio
Silicato de circonio, ZrSiO4, más conocido bajo el nombre de mineral circón, es el compuesto de circonio más común que se encuentra en la naturaleza. Es la fuente más importante de circonio y sus compuestos, que también se utiliza como piedra preciosa.
Los compuestos orgánicos de circonio son en su mayoría inestables. Complejos orgánicos de circonio, así llamados. circonocenos, con radicales como el ciclopentadienilo. Son técnicamente importantes como catalizadores en la polimerización de alquenos, especialmente para la producción de polipropileno. Otra aplicación de un compuesto orgánico de circonio está en hydrozirconation, Estos alquenos están usando el reactivo Schwartz Cp2ZrHCl (Cp = ciclopentadienilo) convertido en alcoholes o hidrocarburos halogenados. En la reacción de alquinos terminales con el reactivo de Schwartz surgen en los enlaces dobles trisustituidos por hidrozirconación, la reacción adicional con un reactivo electrofílico conduce a alquenos transfuncionalizados en alta pureza estereoquímica.
Los complejos de aluminio y circonio se pueden usar como antitranspirantes.
Hexafluoridozirconato de potasio (IV) K2ZRF6 (CAS: 16923-95-8) se puede usar para separar el circonio del hafnio.
El carbonato de circonio existe como complejo básico. Se utiliza, entre otras cosas, en la industria del papel.
| General | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre, símbolo, número atómico | Circonio, Zr, 40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| serie | Los metales de transición | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 4, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | blanco plateado | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS | 7440-67-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fracción de masa de la capa de tierra | 0,021% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| nuclear | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| masa atómica | 91,224 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calculado) | 155 (206) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| configuración electrónica | [Kr] 4d2 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionización | 640,1 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionización | 1270 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ionización | 2218 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. ionización | 3313 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| físicamente | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| estado físico | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modificaciones | dos (α- / β-Zr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| estructura cristalina | hexagonal; cúbico> 1140 K (867 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| densidad | 6,501 g / cm3 (25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| dureza de Mohs | 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismo | paramagnético = 1,1 10-4) = 1,1 10-4) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto de fusión | 2130 K (1857 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto de ebullición | 4682 K (4409 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen molar | 14,02 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 590,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| calor de fusión | 16,9 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| presión de vapor | 0,00168 Pa en 2125 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| velocidad del sonido | 4650 (largo), 2250 (trans.) M / s en 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica específica | 270,0 J / (kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad electrica | 2,36 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| conductividad térmica | 22,7 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Químico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| estados de oxidación | 4, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| potencial normales | −1,553 V (ZrO2 + 4 H.+ + 4 e- → Zr + 2 H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| electronegatividad | 1,33 (escala Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| isótopo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| propiedades de RMN | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| seguridad | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
Precios del circonio
Precio del circonio -> precios de los metales estratégicos


