Níquel, Ni, número atómico 28
Precio de níquel, ocurrencia, extracción y uso
El níquel es un elemento químico con el símbolo del elemento Ni y el número atómico 28. Pertenece a los metales de transición, en la tabla periódica está detrás del método de conteo anterior en 8. Subgrupo o grupo hierro-platino, según el más nuevo en el grupo 10 o grupo de níquel.
Historia
Nickel fue representado por primera vez exclusivamente por Axel Frederic Cronstedt 1751 y recibió el nombre del mineral cuproníquel (kopparníquel sueco, hoy Nickelin) en el que encontró el metal hasta ahora desconocido.
Los mineros medievales usaban el término cuproníquel para referirse al mineral, que parecía mineral de cobre, pero del que no se podía obtener cobre, como si los espíritus de las montañas los hechizaran ("níquel"). Una etimología similar a la del kobold se puede encontrar en el cobalto.
La primera moneda de níquel puro fue acuñada 1881.
Ocurrencia
El níquel se produce en la corteza terrestre con un contenido de aproximadamente 0,008%. La evidencia geofísica y geoquímica sugiere que la mayor parte del níquel se encuentra en la Tierra y otros planetas terrestres en el núcleo, donde forma una aleación con hierro y algunos elementos ligeros. En el núcleo de la Tierra, su fracción de masa según los últimos modelos es de aproximadamente 5,2%.
Sólido, que está en forma elemental, el níquel es raro. Hasta ahora, solo se han documentado ubicaciones de 50 para níquel sólido documentado (2018), incluso en Australia, China, Canadá, Rusia y los Estados Unidos de América.
Tradicionalmente, la mayoría de la producción de níquel proviene de minerales sulfídicos como pentlandita (aproximadamente 34% de níquel), grava magnética de níquel (pirrotita y aglomerado de pentandita) y algunos otros minerales de níquel como millerita (aproximadamente 64-65% de níquel) y níquel (aproximadamente 44% Nickel) ganó. Además, los minerales de níquel lateríticos, principalmente de Garnierit, una mezcla de Népouit (aproximadamente 46% níquel) y Willemseit (aproximadamente 29% níquel), se extraen como materias primas para la producción de níquel. En general, algunos minerales de níquel 200 son conocidos hasta la fecha, y algunos tienen contenidos de níquel mucho más altos que los ya mencionados, pero son mucho menos comunes que estos. Por ejemplo, la bunsenita muy rara es el mineral con el mayor contenido de níquel de hasta 78,58%. Los igualmente raros Minerales Heazlewoodita y Awaruit contienen entre 72 y 73% níquel.
La extracción está cambiando debido a la explotación de los depósitos sulfídicos clásicos cada vez más a minerales de níquel lateríticos. Sin embargo, estos deben ser laboriosamente obtenidos mediante lixiviación ácida a alta presión (lixiviación ácida a alta presión en inglés).
Para poder degradar económicamente el níquel, el contenido de níquel del mineral debe ser al menos 0,5%. Las ocurrencias más importantes se encuentran en Canadá (Cuenca de Sudbury), Nueva Caledonia, Rusia (Norilsk y Península de Kola), Australia (Queensland) y Cuba (Bahía de Moa y Nicaro). Un compañero común al níquel es el cobalto.
Níquel como mineral

El níquel natural en su forma elemental fue descrito por primera vez por Paul Ramdohr 1967 y reconocido por la Asociación Mineralógica Internacional (IMA) como una especie mineral independiente (número de entrada interna del IMA: 1966-039).
Según la clasificación de minerales según Strunz (edición 9) de níquel bajo el sistema no. 1.AA.05 (Elementos - Metales y Compuestos Intermetálicos - Familia Cupalita de Cobre - Grupo Cobre) respectivamente en el 8 obsoleto. Edición incluida en I / A.04b (serie de níquel). La clasificación de minerales según Dana, que se usa predominantemente en países de habla inglesa, lidera el elemento mineral bajo el sistema no. 01.01.11.05 (grupo hierro-níquel).
El tipo de localidad es la península de Bogotá, cerca de Canala, en la provincia norteña de Nueva Caledonia, donde se encontró níquel nativo en forma de granos cúbicos idiomórficos o cubos encarnados hasta aproximadamente 0,1 mm como inclusiones en Heazlewoodita y como una masa irregular de "araña" entre los Heazlewooditkörnern. Los minerales acompañantes además de la Heazlewoodita incluyen calcopirita, calcocita, galena, Godlevskit, cobre sólido, millerita, orcelita, pentlandita, pirita y pirrotita.
Extracción y presentación.
La mayoría del níquel se deriva de minerales de níquel y cobre que contienen cobre, como la grava magnética de níquel. Para hacer la extracción económicamente, el níquel primero debe enriquecerse por flotación a aproximadamente un cinco por ciento de contenido de níquel. Luego, el mineral se tuesta de manera similar a la producción de cobre. Aquí, el mineral primero se tuesta previamente para convertir una porción del sulfuro de hierro en óxido de hierro. Posteriormente, se añaden silicatos y coque para escoriar el óxido de hierro como silicato de hierro. Al mismo tiempo, la piedra en bruto de cobre y níquel se forma a partir de níquel, cobre y sulfuro de hierro. Como esto es específicamente más pesado que la escoria de silicato de hierro, las dos fases se pueden aprovechar por separado.
Posteriormente, la piedra en bruto se llena en un convertidor y se agrega sílice. Se inyecta con oxígeno. Como resultado, el sulfuro de hierro restante se tuesta a óxido de hierro y luego se lava. El resultado es la piedra fina de cobre-níquel, que consiste en aproximadamente 80% de cobre y níquel y aproximadamente 20% de azufre.
| Posición | CARGA TERRESTRE | Producción (en millones de t) |
|---|---|---|
| 1 | Indonesia | 400.000 |
| 2 | Filipinas | 230.000 |
| 3 | Caledonia | 210.000 |
| 4 | Canadá | 210.000 |
| 5 | Australia | 190.000 |
| 6 | Rusia | 180.000 |
| 7 | Brasil | 140.000 |
| 8 | República Popular de China | 98.000 |
| 9 | Guatemala | 68.000 |
| 10 | Cuba | 51.000 |
Extracción de Rohnickel
Para recuperar los Rohnickels, el níquel debe separarse del cobre. Para este propósito, la piedra fina se fusiona con sulfuro de sodio Na2S. Solo se forma un ligero sulfuro doble de fusión entre el cobre y el sulfuro de sodio. Se forman dos fases fáciles de separar de sulfuro doble de cobre-sodio (líquido) y sulfuro de níquel. Después de la separación, el sulfuro de níquel se tuesta a óxido de níquel y luego se reduce a níquel con coque.
Para recuperar níquel puro, el Rohnickel se refina por electrólisis. Para este propósito, el Rohnickel está conectado como un ánodo, un Nickelelfeinblech como un cátodo en una celda electrolítica. El electrolito utilizado es una solución de sal de níquel. Durante la electrólisis, el níquel y todos los componentes menos nobles se disuelven en el ánodo. Todos los componentes más nobles permanecen sólidos y caen debajo del electrodo como lodo anódico. Esto sirve como una fuente importante para la producción de metales preciosos, como el oro o el platino. En el cátodo, los iones de níquel de la solución se reducen a níquel, todos los componentes menos nobles permanecen en solución. La pureza del níquel electrolítico es de alrededor del 99,9%.
Para la extracción de níquel puro con una pureza de 99,99% hay un proceso especial llamado proceso de la luna, llamado así por Ludwig Moon, quien descubrió el tetracarbonilo de níquel 1890. Este proceso se basa en la formación y descomposición de tetracarbonilo de níquel. Para este fin, el polvo de Rohnickel finamente dividido se introduce en una corriente de monóxido de carbono a 80ºC. Esto forma tetracarbonilo de níquel gaseoso. Esto se libera del polvo de la chimenea y se envía a una cámara de descomposición caliente 180 ° C. En el interior hay pequeñas bolas de níquel. En este punto, el tetracarbonilo de níquel se descompone nuevamente en níquel y monóxido de carbono. Esto da como resultado níquel muy puro.
la representación laboral
Existen diferentes métodos para representar pequeñas cantidades de níquel muy puro en el laboratorio:
Reducción del óxido con hidrógeno a 150 ° C a 250 ° C:
Reducción de una suspensión de cloruro de níquel (II) en éter dietílico a través de una reacción de Grignard
Descomposición térmica de oxalato de níquel (II) en ausencia de oxígeno:
Reducción de cloruro de níquel (II) con una dispersión de sodio:
En particular, la termólisis del oxalato proporciona polvo de níquel pirofórico finamente dividido.
Propiedades
Propiedades fisicas
El níquel es un metal blanco plateado que es uno de los metales pesados con una densidad de 8,91 g / cm3. Es de dureza media (dureza de Mohs 3,8), forjable, dúctil y se puede pulir muy bien. El níquel, como el hierro y el cobalto, es ferromagnético, con una temperatura de Curie de 354 ° C. El metal cristaliza en una estructura de cristal centrada en la cara cúbica (tipo cobre) en el grupo espacial Fm3m (número de grupo espacial 225) con el parámetro de red a = 352,4 pm, así como cuatro unidades de fórmula por celda unitaria. Esta estructura la retiene incluso a altas presiones de hasta al menos 70 GPa. Otra modificación metaestable con empaquetamiento esférico centrado en el cuerpo cúbico podría obtenerse en capas delgadas sobre arseniuro de hierro o galio. Tiene una temperatura Curie significativamente más baja con 183 ° C.
La resistencia a la tracción del níquel recocido en 400-450 MPa está en un alargamiento a la rotura entre 30 y 45%. Los valores de dureza están alrededor del 80 HB. El níquel reforzado en frío cuyo alargamiento en la rotura es inferior a 2% logra resistencias de hasta 750 MPa con valores de dureza alrededor de 180 HB. Los productos semiacabados de níquel puro con un contenido de 99% Ni se pueden fortalecer en frío.
El isótopo 62Ni tiene la energía de unión más alta por nucleón de todos los isótopos de todos los elementos.
Propiedades quimicas
El níquel es muy estable a temperatura ambiente al aire, agua, ácido clorhídrico y álcalis. Los ácidos diluidos atacan al níquel solo muy lentamente. En comparación con los ácidos oxidantes concentrados (ácido nítrico), la pasivación ocurre de manera análoga al acero inoxidable. El níquel es soluble en ácido nítrico diluido (aproximadamente 10 a 15 por ciento). Incluso un ácido nítrico medio concentrado (aproximadamente 30 por ciento) causa una pasivación notable. El estado de oxidación más común es + II, más raramente se observan -I, 0, + I, + III y + IV. En el níquel tetracarbonilo, el níquel tiene el número de oxidación 0. Las sales de níquel (II) se disuelven en agua para formar complejos aqua de color verdoso.
El níquel finamente dividido reacciona con monóxido de carbono a 50 a 80 ° C para formar tetracarbonilo de níquel, Ni (CO) 4, un líquido incoloro y muy tóxico. Esto sirve como un intermediario para la producción de níquel puro por el proceso lunar. De 180 a 200 ° C, el níquel tetracarbonilo se descompone nuevamente en níquel y monóxido de carbono.
Fisiología
La controvertida esencialidad del níquel se contrasta con la existencia de varias enzimas que normalmente contienen níquel, pero que no dependen de él porque su papel como catión puede ser asumido por otros cationes divalentes. En humanos, estas son tres proteínas que se sabe que se unen al níquel:
la alfafetoproteína se une al níquel, pero no depende de él, ya que no hay enzima
La acireductona dioxigenasa, una enzima de la vía de recuperación de metionina que típicamente se une al níquel u otro catión divalente
Polirribonucleótido 5'-hidroxil quinasa Clp1, que requiere como cofactor magnesio, manganeso o níquel
Para las plantas y diversos microorganismos, la esencialidad del níquel se debe al aislamiento de varias enzimas (por ejemplo, ureasa, Co-F430) que contienen níquel en el sitio activo, así como a la detección de deficiencias en entornos pobres en níquel, que se mejoran mediante la adición de Ni (II ) Sales, aseguradas.
En electrofisiología, los iones de níquel se utilizan para bloquear los canales de calcio activados por voltaje.
Problemas de salud
El níquel es la causa más común de alergia de contacto con dermatitis por níquel: en Alemania, se estima que entre 1,9 y 4,5 millones de personas están sensibilizadas al níquel. Debido a esto, los metales y las aleaciones que entran en contacto con la piel son cada vez menos niquelados. Alrededor del 10% de todos los niños están sensibilizados al níquel. Tras un contacto renovado con el alergeno, pueden reaccionar con una alergia de contacto.
Según la Autoridad Europea de Seguridad Alimentaria (EFSA), la ingesta diaria tolerable (TDI) de níquel es microgramos 2,8 (miligramos 0.0028) por kilo de peso corporal. 2019 hizo que la Cámara de Trabajo de la Alta Austria examinara doce bebidas de soya diferentes en la Agencia de Salud y Seguridad Alimentaria. Los valores estaban entre 0,25 (Dennree bebida de soya natural) y 0,69 miligramos por litro (sí, por supuesto, bebida de soja orgánica). En la leche de soya más alta en calorías, un kilo 30 de niños pesados ya ha consumido más del doble de níquel en un cuarto de litro, según lo recomendado por la EFSA.
La inhalación de compuestos inorgánicos de níquel se asocia con un mayor riesgo de cáncer de carcinoma de células escamosas de pulmón y tracto respiratorio superior. Tales neoplasias malignas se reconocen como enfermedades profesionales en Alemania por exposición ocupacional (BK 4109). Además, el mayor contenido de níquel en el aire y el agua potable es un factor de riesgo para la sensibilización del níquel en los niños.
El uso de níquel en bienes de consumo (como relojes de pulsera, juguetes, equipos de procesamiento de alimentos, etc.) está limitado por la normativa de la Unión Europea, que ha sido implementado en Alemania por la Ordenanza de bienes de consumo, que establece valores límite para la liberación.
Utilizar
El níquel se necesita como metal en pequeñas cantidades, la mayor parte de la producción se destina a la producción de aceros inoxidables y aleaciones de níquel. El níquel se usa en muchos bienes industriales y de consumo específicos e identificables, incluidos el acero inoxidable, los imanes Alnico, las monedas, las baterías recargables, las cuerdas de guitarra eléctrica, las cápsulas de micrófono, el revestimiento de accesorios de plomería y aleaciones especiales como Permalloy, Elinvar e Invar. Se utiliza para recubrir y como tinte en vidrio. Las reservas de depósitos de níquel agotados desde el punto de vista actual se encuentran entre 70 y 170 millones de toneladas. Actualmente, cada año se producen más de un millón de toneladas (2006: 1,340 millones de toneladas) en todo el mundo. El precio del níquel a veces está sujeto a fluctuaciones de precios muy altas debido a la especulación del mercado financiero.
Alrededor del 25 por ciento del depósito mundial de níquel se encuentra en Nueva Caledonia, un territorio francés de ultramar.

Batería de níquel cadmio, imagen Wikipedia
Utilizar como metal
El níquel metal puro se usa en forma finamente dividida como catalizador en la hidrogenación de ácidos grasos insaturados. Debido a su resistencia química, el níquel se usa para aparatos en el laboratorio químico y la industria química (por ejemplo, crisoles de níquel para digestiones). De níquel metal aleaciones de níquel, z. Por monedas.

Alambre de níquel (alambre), el alambre de níquel se puede tirar hasta 0,01mm de espesor
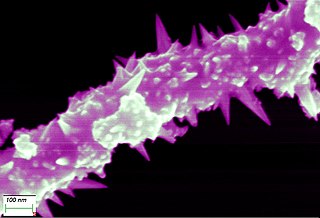
Alambre de níquel 0,01mm en consideración por un microscopio de alto rendimiento
El níquel sirve como metal de recubrimiento para la protección contra la corrosión ("niquelado") de objetos metálicos: debido a sus propiedades de protección contra la oxidación, los metales (en particular el hierro) están recubiertos con una capa de níquel para ciertos fines técnicos mediante tecnología galvánica.
El metal también se usó antes para hacer los marcos de las gafas de níquel.
Como emisor beta, el isótopo de níquel 63Ni se usa en detectores de captura de electrones en cromatógrafos de gases.
Usar como aleación
El níquel es un importante metal de aleación que se utiliza principalmente para el acabado del acero. La mayor parte del níquel va allí. Hace que el acero sea resistente a la corrosión y aumenta su dureza, tenacidad y ductilidad. Los aceros de alta aleación con níquel se utilizan en entornos particularmente corrosivos. El acero inoxidable V2A (el nombre proviene del "lote de prueba 2 austenítico" en la acería de Krupp, corresponde a X12CrNi18-8) contiene 8% de níquel además de 18% de cromo, V4A (nombres comerciales Cromargan o Nirosta) 11% además de 18% de cromo y 2% de molibdeno.

Imagen de monedas de níquel Wikipedia
El níquel es un excelente agente de aleación para ciertos metales preciosos y se utiliza en la prueba de fuego como un colector de elementos del grupo del platino. Como tal, el níquel es capaz de recolectar completamente los seis elementos del grupo del platino, especialmente platino y paladio, de minerales y recolectar parcialmente oro.
La espuma de níquel o la malla de níquel se utilizan en electrodos de difusión de gas para pilas de combustible alcalinas.
El níquel y sus aleaciones a menudo se usan como catalizadores para reacciones de hidrogenación. El níquel Raney, una aleación de níquel-aluminio finamente dividida, es una forma común, aunque también se utilizan catalizadores relacionados, incluidos los catalizadores de tipo Raney.
Aproximadamente el 20% del níquel se usa (en Alemania) para la producción de otras aleaciones de níquel:
Konstantan, una aleación de 55% cobre y 45% níquel, que tiene una resistividad eléctrica aproximadamente constante en un amplio rango de temperaturas. Se utiliza principalmente para resistencias precisas.
Las superaleaciones a base de níquel son aleaciones especialmente para su uso a altas temperaturas y bajo medios corrosivos. Se utilizan, por ejemplo, en turbinas de aviones y turbinas de gas de centrales eléctricas.
Níquel Raney, una aleación de níquel-aluminio que es un catalizador importante para la hidrogenación de compuestos orgánicos.
Alpaca, una aleación de cobre-níquel-zinc con un contenido de níquel 10-26%, que es particularmente resistente a la corrosión y se utiliza principalmente para cubiertos y equipos electrotécnicos.
Monel, también una aleación de cobre y níquel con aproximadamente 65% de níquel, 33% de cobre y 2% de hierro, que se caracteriza por una resistencia química particular, incluido el flúor. Por lo tanto, se utiliza para cilindros de gas flúor.
Hierro dúctil austenítico, un hierro fundido esferoidal especial con hasta 20% de níquel, para uso en ambientes corrosivos y a altas temperaturas.
prueba
La reacción de detección de las sales de níquel (II), que generalmente son solubles en agua con color verde, se lleva a cabo gravimétricamente y cualitativamente en la separación cuantitativa con solución de dimetilglioxima (reactivo de Tschugajew). Las sales de níquel se precipitan previamente opcionalmente por sulfuro de amonio como sulfuro de níquel (II) gris-negro y se disuelven en ácido nítrico. La detección específica es posible por reacción con dimetilglioxima en solución amoniacal. El bis (dimetilglyoximato) níquel (II) rojo frambuesa precipita como un complejo:
Dado que el níquel se precipita cuantitativamente de una solución de amoniaco con dimetilglioxima, esta detección también es útil para el análisis cuantitativo gravimétrico de níquel. A partir de la solución amoniacal, también se puede hacer una determinación cuantitativa por medio de electrogravimetría en un electrodo de malla de platino. Al igual que otros metales pesados, el níquel hoy en día también se determina cuantitativamente por espectroscopía atómica o espectrometría de masas en la región de ultratraza. Extremadamente sensible es la voltamperometría inversa con acumulación adsorbente del complejo Ni-dimethyglyoxime en gotas colgantes de mercurio o película de mercurio.
Conexiones
El níquel se produce en compuestos principalmente en el estado de oxidación + II. Los niveles 0, + I, + III y + IV son raros y generalmente inestables. El níquel forma una variedad de complejos en su mayoría coloreados.
Óxido
El óxido de níquel (II) y el óxido de níquel (III) son sólidos verdes y negros, respectivamente, y se utilizan para fabricar cerámicas, vidrios y electrodos. Además, se utilizan como catalizadores para la hidrogenación de compuestos orgánicos. A menudo, como muchos otros óxidos metálicos binarios, el óxido de níquel (II) no es estequiométrico, lo que significa que la relación níquel-oxígeno se desvía de 1: 1. Esta propiedad se acompaña de un cambio de color en el que el óxido de níquel (II) estequiométricamente correcto es verde y el óxido de níquel (II) no estequiométrico es negro. El óxido de níquel (III) tiene un fuerte efecto oxidante y es desconocido como sustancia pura.
haluros
El cloruro de níquel (II) es un sólido amarillo altamente higroscópico que sirve como tinte para la cerámica y para la producción de catalizadores de níquel. Además de la forma anhidra, todavía hay cloruros de níquel (II) hidratados, z. Como el hexahidrato de cloruro de níquel verde (II), que cristalizó en soluciones acuosas de cloruro de níquel. El cloruro de níquel anhidro (II) tiene una estructura cristalina trigonal de tipo cloruro de cadmio (II) que tiene el grupo espacial R3m (número de grupo espacial 166). El hexahidrato cristaliza en el sistema de cristal monoclínico en el grupo espacial C2 / m (grupo espacial No. 12).
El fluoruro de níquel (II) también es altamente higroscópico y forma cristales tetragonales de color amarillento a verde. A diferencia de muchos fluoruros, es estable en el aire. Cristaliza en el sistema de cristal tetragonal con el grupo espacial P42 / mnm (número de grupo espacial 136). El tetrahidrato cristaliza en el sistema de cristal ortorrómbico con el grupo espacial P21ab (número de grupo espacial 29, posición 3).
Otros compuestos inorgánicos de níquel
El hidróxido de níquel (II) y el hidróxido de óxido de níquel (III) se utilizan para almacenar energía eléctrica en níquel-cadmio y otros acumuladores de níquel.
El nitrato de níquel (II) se utiliza en la industria de la cerámica como pigmento marrón, en el teñido como mordiente, para el niquelado electrolítico, para la recuperación de óxido de níquel (II) y para la producción de catalizador puro de níquel. El nitrato de níquel (II) es un oxidante fuerte y generalmente se presenta en forma de hexahidrato Ni (NO3) 2 · 6 H2O.
El sulfato de níquel (II) y el sulfato de amonio y níquel (II) se utilizan en el revestimiento (revestimiento de níquel). El sulfato de níquel (II) es el compuesto de níquel más importante técnicamente. Se utiliza para la producción de otros compuestos y catalizadores de níquel. Las soluciones acuosas de sulfato de níquel (II) y cloruro de níquel (II) se utilizan para la electrodeposición de capas metálicas de níquel. Además, se utiliza en la tintura como mordiente y en la producción de máscaras de gas.
El carbonato de níquel (II) se presenta en varias formas de hidratos. Se utiliza como catalizador en el endurecimiento de grasas y para la producción de óxido de níquel (II), pinturas cerámicas (pigmentos) y esmaltes y en galvanoplastia. Se formó un sistema de cristal trigonal con el grupo espacial R3c (número de grupo espacial 161).
El sulfuro de níquel (II) precipita a partir de soluciones amoniacales, pero no ácidas, que contienen níquel con sulfuro de amonio. Como resultado, el níquel se puede separar con el grupo sulfuro de amonio en el proceso de separación de cationes.
El antimonuro de níquel es un mineral metálico brillante y tiene un color rojo cobrizo brillante. El antimonuro de níquel se usa como material en placas de campo magnético donde se inserta entre capas magnéticamente sensibles de antimonuro de indio. Las placas de campo magnético cambian su resistencia eléctrica en función de la densidad de flujo magnético y sirven como sensor de campos magnéticos. Forma una estructura de cristal hexagonal en el grupo espacial P63 / mmc (número de grupo espacial 194).
Compuestos orgánicos de níquel
El níquel tetracarbonil Ni (CO) 4 es un líquido incoloro y muy tóxico. Es un intermedio importante en el proceso de la luna. El níquel tetracarbonilo fue el primer compuesto de metal carbonilo descubierto.
complejos de níquel
Los iones de níquel y especialmente de níquel (II) forman muchos complejos, en su mayoría coloreados. Los números de coordinación 6, 5 o 4 son los más comunes. En el caso de ligandos monodentados débiles, por ejemplo agua, suelen estar presentes como complejos octaédricos y paramagnéticos de alto espín con número de coordinación 6. Los ligandos fuertes, como el cianuro, forman complejos diamagnéticos de bajo espín, cuadrados y planos. La dimetilglioxima también forma un complejo plano-cuadrado, ya que el complejo se estabiliza adicionalmente mediante enlaces de hidrógeno. El último complejo de bis (dimetilglioximato) níquel (II) es importante para la detección química húmeda de níquel. Los complejos de níquel aniónico terminan en "-niccolato".
Ejemplos de complejos de amina son el azul tetraammina níquel (II) y el violeta hexaamina níquel (II) complejo. Ambos compuestos se obtienen mediante la adición de amoníaco a las soluciones de sal de níquel (II):
La adición de cianuro de potasio a las soluciones de sal de níquel (II) produce inicialmente cianuro de níquel (II), que se disuelve en exceso de cianuro de potasio en tetracianoniccolato de potasio amarillo (II):
Se forma un compuesto correspondiente con tiocianato de potasio. Un compuesto muy sensible es el hexafluoroniccolate (IV) de potasio (K2 [NiF6]). El tetracianoniccolatecolate de potasio (II) se puede preparar a partir de níquel monovalente usando un agente reductor fuerte K4 [Ni2 (CN) 6]. Además, hay una variedad de complejos con ligandos orgánicos como etilendiamina o aniones de ácidos carboxílicos.


![{\ displaystyle {\ ce {NiC2O4 -> [T] [] Ni + 2 CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4f5ac7119d30ce593cf99675097e91e39e33a04d)


![{\ displaystyle {\ ce {NiSO4 + 4NH4 + + 4OH- -> [Ni (NH3) 4] SO4 + 4H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fed711e628c3ba92046eb178a459488074a035c9)
![{\ displaystyle {\ ce {Ni (CN) 2 + 2KCN -> K2 [Ni (CN) 4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a2b8181f20f5d9ad99c2900689b699739283d0d)
