Galio, Ga, número atómico 31
Galio: precio, ocurrencia, extracción, uso del galio
General
Galio es un elemento químico que ocurre raramente con el símbolo del elemento Ga y el número atómico 31. En la tabla periódica está en el cuarto período y es el tercer elemento del tercer grupo principal (grupo 4) o grupo de boro. Es un metal de color blanco plateado que es fácil de licuar. El galio no cristaliza en una de las estructuras cristalinas que de otra manera se encuentran a menudo en los metales, sino en su modificación más estable en una estructura ortorrómbica con dímeros de galio. Además, se conocen otras seis modificaciones que se forman bajo condiciones especiales de cristalización o bajo alta presión. En cuanto a sus propiedades químicas, el metal es muy similar al aluminio.
En la naturaleza, el galio se encuentra sólo en pequeña medida y principalmente como mezcla en minerales de aluminio, zinc o germanio; Los minerales de galio son muy raros. En consecuencia, también se obtiene como subproducto en la producción de aluminio o zinc. La mayor parte del galio se procesa en el semiconductor arseniuro de galio, que se utiliza principalmente para diodos emisores de luz.
Ocurrencia
El galio es un elemento raro en la tierra, con un contenido de 19 ppm en la corteza continental, su abundancia es comparable a la del litio y el plomo. No se presenta en forma elemental, sino solo en forma ligada, principalmente en minerales de aluminio, zinc o germanio. Los minerales más ricos en galio incluyen bauxita, minerales de mezcla de zinc y germanita.
Los contenidos de galio son en su mayoría bajos, la bauxita que se encuentra en Surinam con el contenido más alto conocido solo contiene 0,008% de galio. Las reservas de galio en bauxita en todo el mundo son 1,6 · 106 Toneladas estimadas. En la germanita se encuentran contenidos más altos de hasta 1% de galio. Solo en la mina Apex en el estado estadounidense de Utah se encuentran los minerales tan altos que se intentó extraer galio. Sin embargo, esto fracasó al poco tiempo por razones de rentabilidad.
Solo se conocen unos pocos minerales de galio; estos incluyen la galita (CuGaS2), Söhngeit (Ga (OH)3) y tsumgallita (GaO (OH)).
Extracción y presentación.
El galio se obtiene como subproducto en la producción de aluminio a partir de bauxita en el proceso Bayer. La mezcla de aluminato de sodio y galato de sodio disuelta en una solución de hidróxido de sodio sirve como producto de partida. El galio se puede separar del aluminio mediante varios procesos. Una posibilidad es la cristalización fraccionada con la ayuda de dióxido de carbono, precipitando inicialmente preferentemente hidróxido de aluminio, mientras que el galato de sodio más soluble se acumula en la solución de hidróxido de sodio. El hidróxido de galio solo se precipita después de otros pasos del proceso, mezclado con hidróxido de aluminio. A continuación, la mezcla se disuelve en una solución de hidróxido de sodio y se obtiene galio por electrólisis. Dado que este proceso es intensivo en energía y mano de obra, solo se utiliza en países con costos bajos, como la República Popular China.
El galio también se puede obtener directamente de la solución de hidróxido de sodio por electrólisis. Los cátodos de mercurio se utilizan para este propósito, formándose una amalgama de galio durante la electrólisis. También es posible agregar amalgama de sodio a la solución.
Con la ayuda de hidroxiquinolinas especiales como ligandos quelantes, es posible extraer galio de la sosa cáustica con queroseno y así separarlo del aluminio. Otros elementos, que también se extraen, se pueden separar con ácidos diluidos. El compuesto de galio restante se disuelve luego en ácido clorhídrico o sulfúrico concentrado y se reduce electrolíticamente al metal.
El galio muy puro es necesario para muchas aplicaciones técnicas; para los semiconductores, por ejemplo, solo puede contener una cien millonésima parte de sustancias extrañas. Los posibles métodos de limpieza son la destilación al vacío, la cristalización fraccionada o la fusión por zonas.
La cantidad de galio producido es pequeña, en 2008 la producción primaria mundial fue de 95 toneladas. Otra fuente importante es el reciclaje de desechos que contienen galio, de los que se extrajeron 2008 toneladas más de galio en 135. Los principales países productores son la República Popular China, Alemania, Kazajstán y Ucrania, y los Estados Unidos, Japón y el Reino Unido para el reciclaje de galio.
A escala de laboratorio, el galio se puede producir por electrólisis de una solución de hidróxido de galio en una solución de hidróxido de sodio sobre electrodos de platino o tungsteno.
Propiedades
Propiedades fisicas
El galio es un metal blanco plateado, suave (dureza Mohs: 1,5). Tiene un punto de fusión inusualmente bajo para los metales, que es de 29,76 ° C. Después del mercurio y el cesio, es el metal con el punto de fusión más bajo, que también está muy por debajo del de los elementos vecinos aluminio e indio. Esto probablemente se deba a la estructura cristalina inusual que, a diferencia de las estructuras de otros metales, no tiene un alto grado de simetría y, por lo tanto, no es muy estable. Dado que el punto de ebullición es comparativamente alto a 2204 ° C, el galio tiene un área inusualmente grande en la que es líquido. Debido a la difícil cristalización, el galio líquido se puede enfriar fácilmente por debajo del punto de fusión (subenfriamiento) y cristaliza repentinamente cuando se forman los núcleos de cristalización.
Al igual que el silicio, algunos otros elementos y el agua, el galio tiene una anomalía de densidad; su densidad en estado líquido es aproximadamente un 3,2% más alta que en forma sólida. Esto es típico de sustancias que tienen enlaces moleculares en estado sólido.
El galio es diamagnético en estado sólido, pero se vuelve paramagnético en estado líquido ( = 2,4 10-6 a 40 ° C)
= 2,4 10-6 a 40 ° C)
La formación de enlaces galio-galio es característica de sus estructuras. Se conocen varias modificaciones que se forman bajo diferentes condiciones de cristalización (cuatro modificaciones conocidas, α- a δ-galio, bajo presión normal) y bajo presión (un total de tres modificaciones adicionales a alta presión, Ga-II, Ga-III, Ga-IV). La modificación más estable a temperatura ambiente es el α-galio, que cristaliza en una estructura de capa ortorrómbica. Dos átomos unidos entre sí mediante un enlace covalente forman un dímero. Cada átomo de galio también es adyacente a otros seis átomos de otros dímeros. Existen enlaces metálicos entre los dímeros individuales. Los dímeros de galio son tan estables que inicialmente se retienen incluso cuando se funden y también se pueden detectar en la fase gaseosa.
Se producen más modificaciones durante la cristalización del galio líquido sobreenfriado. A -16,3 ° C, se forma β-galio, que tiene una estructura cristalina monoclínica. En la estructura hay cadenas paralelas en zigzag de átomos de galio. Si la cristalización se produce a una temperatura de -19,4 ° C, se forma δ-galio trigonal, en el cual, comparable al α-boro, hay icosaedros distorsionados formados por doce átomos de galio. Estos están conectados entre sí a través de átomos de galio individuales. A -35,6 ° C, finalmente se forma γ-galio. En esta modificación ortorrómbica, los tubos se forman a partir de Ga interconectados7Anillos en el medio de una cadena lineal de otros átomos de galio.
Si el galio se coloca a alta presión a temperatura ambiente, se forman varias modificaciones de alta presión una tras otra cuando se aumenta la presión. La modificación cúbica de galio-II es estable por encima de 30 kbar, en los que cada átomo está rodeado por ocho más. Si la presión aumenta a 140 kbar, el metal ahora cristaliza como galio-III tetragonal en una estructura que corresponde a la del indio. Si la presión se aumenta más a aproximadamente 1200 kbar, finalmente se forma la estructura cúbica centrada en la cara del galio IV.
Propiedades quimicas
Las propiedades químicas del galio son similares a las del aluminio. Así, el galio se pasiva por la formación de una densa capa de óxido en el aire y no reacciona. Solo en oxígeno puro a alta presión el metal arde con una llama brillante para formar el óxido. Del mismo modo, tampoco reacciona con el agua, ya que aquí se forma el hidróxido de galio insoluble. Por otro lado, si el galio está aleado con aluminio y es líquido a temperatura ambiente debido a la disminución del punto de fusión, reacciona de forma muy violenta con el agua. El galio también reacciona rápidamente con halógenos para formar las correspondientes sales GaX3.
El galio es anfótero y soluble tanto en ácidos como en bases con desprendimiento de hidrógeno. En ácidos, como el aluminio, se forman sales con Ga3+Iones, en bases galatos de la forma [Ga (OH)4]-. Se disuelve lentamente en ácidos diluidos y rápidamente en agua regia y sosa cáustica concentrada. El galio es pasivado por ácido nítrico.
![\ mathrm {2 \ NaOH + 2 \ Ga + 6 \ H_2O \ rightarrow 2 \ Na [Ga (OH) _4] + 3 \ H_2 \ uparrow}](https://upload.wikimedia.org/wikipedia/de/math/7/e/6/7e633a1c6ed8f76b3ebfabbcaba5e544.png)
- Reacción de galio con soda cáustica
La mayoría de los metales son atacados por el galio líquido, por lo que solo se puede almacenar en recipientes de cuarzo, vidrio, grafito, óxido de aluminio, tungsteno hasta 800 ° C y tantalio hasta 450 ° C.
isótopo
Hay un total de 30 isótopos de galio entre 56Ga y 86Ga y otros siete isómeros del núcleo conocidos. De estos son dos 69Ga y 71Ga estable y también se producen en la naturaleza. En la composición isotópica natural predomina 69Ga con 60,12%, 39,88% son 71Ga. De los isótopos inestables 67Ga tiene la vida media más larga con 3,26 días, las otras vidas medias van desde segundos hasta un máximo de 14,1 horas. 72Ga.
Dos isótopos de galio, 67Ga y el de corta duración con una vida media de 67,71 minutos 68Los ga se utilizan en medicina nuclear como trazadores para la tomografía por emisión de positrones. 67Ga se produce en un ciclotrón, mientras que en la producción de 68No se necesita ciclotrón. En cambio, el isótopo de germanio de vida más larga 68Ge por irradiación de 69Ga generado con protones. Esto se desmorona 68Ga, el resultante 68Ga se puede extraer en un generador de galio-68. Para los estudios, el galio generalmente se une en un complejo con un ligando fuertemente quelante como el ácido 1,4,7,10-tetraazaciclododecano-1,4,7,10-tetraacético (DOTA).
Utilizar
Debido a la rareza del elemento, el galio solo se usa de forma limitada. Varios compuestos de galio se obtienen a partir de la mayor parte del galio producido. Los económicamente más importantes con diferencia son aquellos con elementos del quinto grupo principal, sobre todo arseniuro de galio, que se requiere para las células solares y los diodos emisores de luz, entre otras cosas. En 5, el 2003% del galio producido se utilizó para este propósito. También sirve como material para dopar el silicio (dopaje p).
El amplio rango de temperatura en el que el elemento es líquido y la baja presión de vapor al mismo tiempo se utilizan para la construcción de termómetros. Los termómetros de galio se pueden utilizar hasta temperaturas de 1200 ° C. El galio líquido se puede utilizar como líquido de barrera para medir el volumen de gases a temperaturas más altas y como material de electrodo líquido en la extracción de metales ultrapuros como el indio.
El galio tiene una alta humectabilidad y una buena reflectividad y, por lo tanto, se usa como revestimiento para espejos. También se utiliza en aleaciones fundidas, para intercambiadores de calor en reactores nucleares y como reemplazo del mercurio en lámparas.
Las aleaciones de galio con otros metales tienen varios usos. Los materiales magnéticos se crean mediante la aleación con gadolinio, hierro, itrio, litio y magnesio. La aleación con vanadio en la composición V3Ga es un superconductor con una temperatura de transición comparativamente alta de 16,8 K. En las armas nucleares, se alea con plutonio para evitar cambios de fase. Muchas aleaciones de galio como Galinstan son líquidas a temperatura ambiente y pueden reemplazar el mercurio tóxico o las aleaciones muy reactivas de sodio y potasio.
prueba
El galio se puede detectar cualitativamente con varias reacciones de color típicas. Estos incluyen la reacción con rodamina B en benceno, que presenta fluorescencia de amarillo anaranjado a rojo violeta cuando se agrega galio, morina, que muestra fluorescencia verde como en la reacción con aluminio, y hexacianidoferrato de potasio (III), con el galio un precipitado blanco de hexacianidoferrato de galio (III ) formas. Además, es posible una detección espectroscópica a través de las características líneas espectrales violetas a 417,1 y 403,1 nm.
Se pueden proporcionar pruebas cuantitativas mediante valoraciones complexométricas, por ejemplo con ácido etilendiaminotetraacético o mediante espectrometría de absorción atómica.
Toxicología y significado biológico
No existen datos toxicológicos para el galio metálico; sin embargo, es corrosivo para la piel y las membranas mucosas. Los compuestos nitrato de galio (III) Ga (NO3)3 y óxido de galio (III) Ga2O3 poseer LD oral50Valores en el rango de gramos: 4,360 g / kg para el nitrato y 10 g / kg para el óxido. Por tanto, se considera que el galio es de baja toxicidad y, hasta donde se sabe, no desempeña ningún papel en los seres humanos como oligoelemento.
Conexiones
En los compuestos, el galio se encuentra casi exclusivamente en el estado de oxidación +3. Además, se conocen compuestos de galio (I) raros y en su mayoría muy inestables, así como aquellos que contienen galio mono y trivalente (formalmente compuestos de galio (II)).
Compuestos con elementos del grupo nitrógeno.
Los compuestos técnicamente más importantes del galio son aquellos con los elementos del grupo nitrógeno. El nitruro de galio, el fosfuro de galio, el arseniuro de galio y el antimonuro de galio son semiconductores típicos (semiconductores III-V) y se utilizan para transistores, diodos y otros componentes en la electrónica. En particular, se producen diodos emisores de luz de varios colores como compuestos de grupos de galio y nitrógeno. El color, que depende de la banda prohibida, se puede ajustar por la diferente proporción de los aniones o reemplazando el galio con aluminio o indio. El arseniuro de galio también se utiliza para células solares. Estos se utilizan en satélites en particular, ya que el arseniuro de galio es más resistente a la radiación ionizante que el silicio.
haluros
Haluros de galio de la forma GaX3 son similares en muchas propiedades a los correspondientes compuestos de aluminio. Con la excepción del fluoruro de galio (III), se presentan como dímeros en una estructura de bromuro de aluminio. El cloruro de galio (III) es el único haluro de menor importancia económica. Se utiliza como ácido de Lewis en reacciones de Friedel-Crafts.
Conexiones adicionales
Al igual que el óxido de aluminio, el óxido de galio (III) es un sólido incoloro de alto punto de fusión. Ocurre en cinco modificaciones diferentes, de las cuales la modificación β cúbica es la más estable.
Los compuestos orgánicos de galio existen como Gallane GAR3, Gallylene GAR y como gallans superioresque contienen enlaces galio-galio. Como muchos otros compuestos organometálicos, son inestables al aire y a la hidrólisis. Uno de los pocos compuestos orgánicos de galio de importancia económica es el trimetilgalio, que se utiliza como reactivo de dopaje y para la producción de capas delgadas de arseniuro de galio y nitruro de galio en epitaxia organometálica en fase gaseosa.
| General | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre, símbolo, número atómico | Galio, Ga, 31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| serie | metales | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 13, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | blanco plateado | ||||||||||||||||||||||||||||||||||||||||||||||||
| CAS | 7440-55-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Fracción de masa de la capa de tierra | 14 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||
| nuclear | |||||||||||||||||||||||||||||||||||||||||||||||||
| masa atómica | 69,723 u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calculado) | 130 (136) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | . | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radio | . | ||||||||||||||||||||||||||||||||||||||||||||||||
| configuración electrónica | [Ar] 3d10 4s2 4p1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionización | 578,8 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionización | 1979,3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ionización | 2963 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| físicamente | |||||||||||||||||||||||||||||||||||||||||||||||||
| estado físico | fest | ||||||||||||||||||||||||||||||||||||||||||||||||
| modificaciones | siete | ||||||||||||||||||||||||||||||||||||||||||||||||
| densidad | 5,904 g / cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| dureza de Mohs | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismo | diamagnético = -2,3 10-5) = -2,3 10-5) |
||||||||||||||||||||||||||||||||||||||||||||||||
| punto de fusión | 302,91 K (29,76 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| punto de ebullición | 2477 K (2204 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen molar | 11,80 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 256 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| calor de fusión | 5,59 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| velocidad del sonido | 2740 m / s en 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica específica | 371 J / (kg K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad electrica | acerca de 7,14 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||
| conductividad térmica | 29 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Químico | |||||||||||||||||||||||||||||||||||||||||||||||||
| estados de oxidación | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| potencial normales | −0,53 V (Ga3+ + 3 e- → Ga) | ||||||||||||||||||||||||||||||||||||||||||||||||
| electronegatividad | 1,81 (escala Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| isótopo | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| seguridad | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
 |
Precios de galio, gráficos, precio
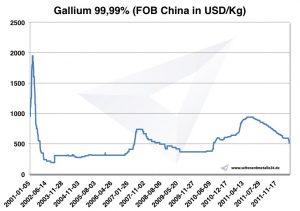
Gráfico de galio 2001-2011
Precios del galio -> Precios del galio a precios de metales estratégicos
